

前
言
影响个体对药物反应的因素很多,包括内源性因素如患者的年龄、性别、种族/民族、遗传、疾病状态和器官功能,其它生理变化如怀孕、哺乳,以及外源性因素如吸烟和饮食等。多项研究证实,基因变异是导致个体疾病表现和药物反应多样性的首要原因,这一观点目前已得到广泛认可。药物基因组学(Pharmacogenomics, PGx)是从遗传学角度解释药物作用个体差异的学科,通过分子生物学方法对个体的药物相关基因进行检测,临床医生可以根据患者的基因分型结果评估药物的反应性,再结合患者的病情及实际经验,“量体裁衣”的选择适合个体的药物种类及剂量,实现提高药物疗效、降低毒副作用的目的,同时能够减轻患者的痛苦和经济负担,合理化配置医疗资源,减少不必要的浪费(见图1)。
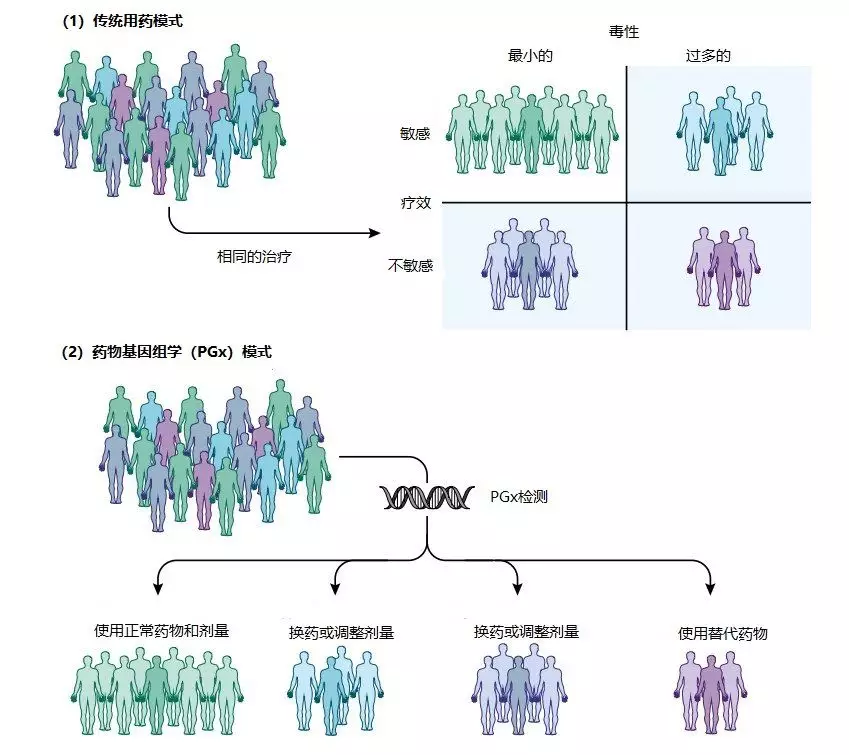
图1 传统的用药模式与药物基因组学(PGx)模式
肾病是一类严重影响人类健康的常见病,其病因复杂,可能发生肾性高血压、肾性贫血、肾性骨病、水电解质紊乱、感染、心衰等并发症,而患者尤其是老年患者往往同时存在心脑血管病、糖尿病等合并症,患者个体差异大,普遍存在联合用药、诊治较为复杂的特点,这也为肾病的精准治疗提出了更高的要求。
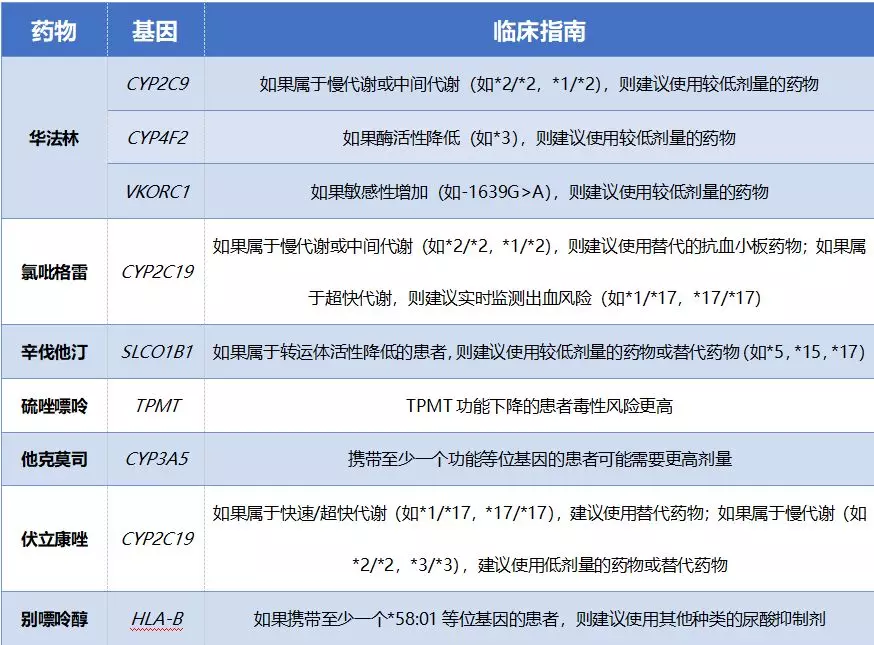
药物体内代谢、转运及药物作用靶点相关基因的遗传变异及其表达水平的变化可通过影响药物在体内的浓度和敏感性,导致药物反应性的个体差异。药物基因组学是基因检测指导肾病精准药物治疗的重要基础,目前美国食品药品监督管理局(Food and Drug Administration, FDA)、欧洲药品管理局(European Medicines Agency, EMA)、药物基因组学知识库(www.pharmacgkb.org/)等为肾病常用的抗凝药物、抗血小板药物、他汀类药物和移植用药提供了较高级别证据的临床推荐(见表1)。
心血管病用药
心血管病是慢性肾病(chronic kidney disease, CKD)患者的主要并发症。继发于CKD的心血管病的特征是心脏重塑、动脉粥样硬化和动脉硬化。目前心血管病的药物基因组学研究和临床应用是最为活跃的一个领域,华法林、氯吡格雷、辛伐他汀等药物的基因检测都已被纳入FDA的药品说明和相关指南中。
01 华法林
华法林是一种维生素K拮抗剂,通过抑制凝血因子II、VII、IX、X和蛋白C、S的形成来抑制凝血,其临床疗效和不良反应存在很大的个体差异,血药浓度过高或敏感性增加可导致严重出血事件。因此,需要在数天至数周内频繁监测国际标准化比率(INR),以确定华法林的最适剂量。肾功能受损的患者在使用华法林时,抗凝效果更差、大出血的发生风险更高,所以需要更低剂量的华法林。
华法林的药代动力学和药效学受多种基因型的影响。已知药物代谢酶CYP2C9、CYP4F2以及影响药物敏感性的VKORC1基因变异是影响华法林剂量的主要遗传因素,临床已用于预测达到最佳抗凝效果(INR)所需的华法林起始剂量。
02 氯吡格雷
抗血小板药物(普拉格雷、替格瑞洛、氯吡格雷)适用于冠状动脉支架置入术以及肾动脉支架植入术后的患者。由于这类药物存在不同的出血、治疗失败和增加用药成本的风险,缺乏有效的治疗反应生物标志物成为其临床应用的主要挑战。
最常用的处方药物氯吡格雷是一种前药,需要经过CYP2C19酶代谢成活性物质才能发挥抗血小板聚集的作用。CYP2C19代谢酶活性降低的患者(慢代谢)体内活性代谢物生成减少,血小板抑制率降低。相反,CYP2C19活性增加的患者(快代谢和超快代谢)由于其氯吡格雷活性代谢物的生成增加,因此,理论上具有更高的血小板抑制率和出血风险。
03 他汀类
辛伐他汀、阿托伐他汀等他汀类药物是常用的降胆固醇药物,肌毒性是他汀类药物罕见且最为严重的不良反应,可进一步发展为横纹肌溶解症。尽管大多数他汀类药物的毒性风险较低,但大剂量(80mg)辛伐他汀的风险可能略高于其他他汀类药物(36mg)。
有机阴离子转运多肽 OATP1B1由SLCO1B1基因编码,该基因第5号外显子的c.521T>C(Val174Ala)多态性是亚洲人群中的主要遗传变异,CC基因型个体OATP1B1对其底物的摄取能力显著降低,使辛伐他汀、阿托伐他汀等药物的血药浓度升高,肌病和横纹肌溶解症的发生风险增加。因此,为了降低肌病等严重不良反应的发生风险,建议临床根据SLCO1B1基因型选择合适种类和剂量的他汀类药物进行治疗。
移植用药
肾移植是慢性肾病5期(终末期)患者的首选治疗方法,移植后用药如硫唑嘌呤、他克莫司、伏立康唑等具有有效治疗窗窄,且患者对药物的反应差异大等特点。如前所述,遗传因素是药物反应个体差异的重要原因,因此,肾移植后用药也是目前药物基因组学临床应用较多的一个领域。
01 硫唑嘌呤
硫唑嘌呤是移植后用于长期维持免疫抑制治疗的抗代谢物,是肾移植患者降低成本的重要策略。硫唑嘌呤作为前体药物在肝脏内经谷胱甘肽转移酶转化为6-巯基嘌呤(6-MP)。6-MP可经TPMT代谢为无活性的6-甲巯基嘌呤(6-MMP)。TPMT活性降低可增加巯嘌呤类药物的造血系统毒性(严重的骨髓抑制)。
FDA已批准在硫唑嘌呤的药品说明书中增加在用药前进行TPMT基因多态性检测的建议。CPIC建议TPMT酶活性低的个体在接受6-MP治疗时减少用药剂量,中间代谢型个体的起始剂量为常规剂量的30~70%,慢代谢型个体应减少至常规用药剂量的1/10,或每周3次给予常规剂量的药物,或考虑更换其他药物,以避免发生严重的造血系统毒性。此外,TPMT活性极高的个体接受常规剂量的6-MP治疗时可能达不到治疗效果。
02 他克莫司
他克莫司是钙调磷酸酶抑制剂,是移植后长期免疫抑制治疗的基础药物。其临床应用以常规治疗的药物监测为特点,治疗窗窄,个体间血药浓度差异大。器官移植患者应用他克莫司后血药浓度偏低可导致急性排斥反应和药物敏感性降低;血药浓度偏高则容易发生肾毒性、神经毒性、糖尿病、高血脂症、高血压和胃肠道紊乱等不良反应。
CYP3A5在他克莫司的代谢中起重要作用,其活性降低可导致他克莫司的血药浓度升高,不良反应增加。CPIC指南建议携带CYP3A5*3/*3基因型的移植患者减少他克莫司的用药剂量,以避免发生药物不良反应。
03 伏立康唑
伏立康唑是一种三唑类抗真菌药物,用于肾移植和侵袭性真菌感染患者。与上述移植后用药相似,伏立康唑的药物反应个体差异性大,治疗窗较窄,需要进行血药浓度监测。
伏立康唑的代谢主要通过CYP2C19进行。CYP2C19 快代谢与慢代谢个体伏立康唑的血药浓度存在显著差异,慢代谢个体在应用常规剂量药物时可能出现毒副反应,建议减少用药剂量;在常规剂量治疗时,若快代谢个体疗效不佳或慢代谢个体出现毒副反应时均应考虑更换药物。FDA批准的药品说明书中指出应用伏立康唑前需检测CYP2C19基因型,以确保用药安全。
高尿酸用药
高尿酸血症是慢性肾病患者最常见的并发症,是疾病进展的独立危险因素。别嘌呤醇通常用于降低尿酸水平,该药是造成药物相关严重皮肤不良反应(severe cutaneous adverse reactions , SCARs)的主要原因之一,包括中毒性表皮坏死溶解和Steven Johnson综合征。
药物引起的严重皮肤不良反应的风险与主要组织相容性复合体(MHC)位点的HLA-B*58:01等位基因有关。HLA-B*58:01最初在东亚人群中发现,研究证实,该位点是别嘌呤醇严重皮肤反应的最大危险因素和特异性基因标志物。携带至少一个HLA-B*58:01等位基因的患者,使用别嘌呤醇发生严重皮肤不良反应的风险更高。CPIC指南建议,携带HLA-B*58:01等位基因的患者禁用别嘌呤醇。
参考文献
[1]Johnson JA, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for pharmacogenetics-guided warfarin dosing. Clin Pharmacol Ther 102: 397–404, 2017.
[2] Scott SA, et al. Clinical Pharmacogenetics Implementation Consortium: Clinical Pharmacog- enetics Implementation Consortium guidelines for CYP2C19 genotype and clopidogrel therapy. Clin Pharmacol Ther 94: 317–323, 2013.
[3]Ramsey LB, et al. The clinical pharmacogenetics implementation consortium guideline for SLCO1B1 and simvastatin-induced myopathy. Clin Pharmacol Ther 96: 423–428, 2014.
[4]Relling MV, et al. Clinical Pharmacogenetics Implementation Consortium: Clinical Pharmaco- genetics Implementation Consortium guidelines for thiopurine methyltransferase genotype and thiopurine dosing. Clin Pharmacol Ther 89: 387–391, 2011.
[5]BirdwellKA, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for CYP3A5 genotype and tacrolimus dosing. Clin Pharmacol Ther 98: 19–24, 2015.
[6]Moriyama B, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for CYP2C19 and voriconazole therapy. Clin Pharmacol Ther 102: 45-51, 2017
[7]Hershfield MS, et al. Clinical Pharmacogenetics Implementation Consortium guidelines for human leukocyte antigen-B genotype and allopurinol dosing. Clin Pharmacol Ther 93: 153–158, 2013.
[8]Solomon M, et al. Clinical Pharmacogenomics Applications in Nephrology. Clin J Am Soc Nephrol 13:2018.
图/文:医学部
编 辑:市场部