去年年底,中国科学院生物化学与细胞生物学研究所的周斌团队与交通大学国际妇幼保健院的黄荷凤团队在Circulation期刊上发表了题为“In Vivo AAV-CRISPR/Cas9-mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia”的文章,发现利用AAV-CRISPR/Cas9系统对携带可导致家族性高胆固醇血症(FH)的致病Ldlr突变小鼠进行LDLR基因校正,能够部分地修复低密度脂蛋白受体(LDLR)表达并有效改善LDLR突变体中的动脉粥样硬化,为FH患者的治疗提供潜在的治疗方法。
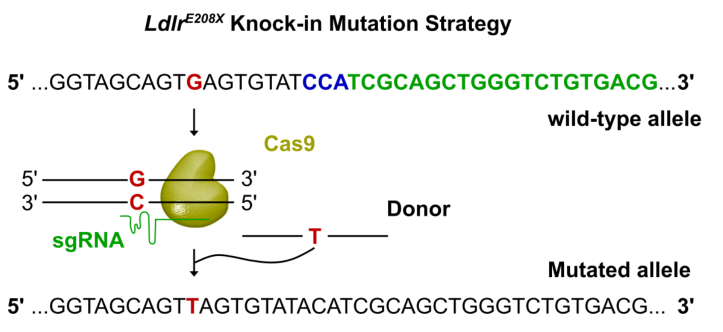
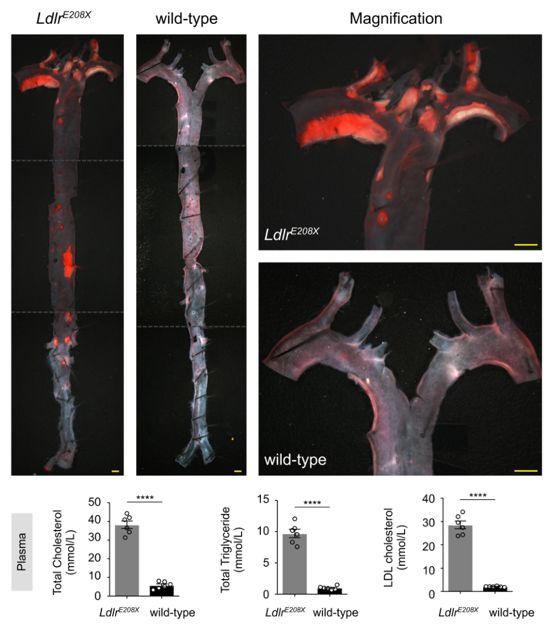
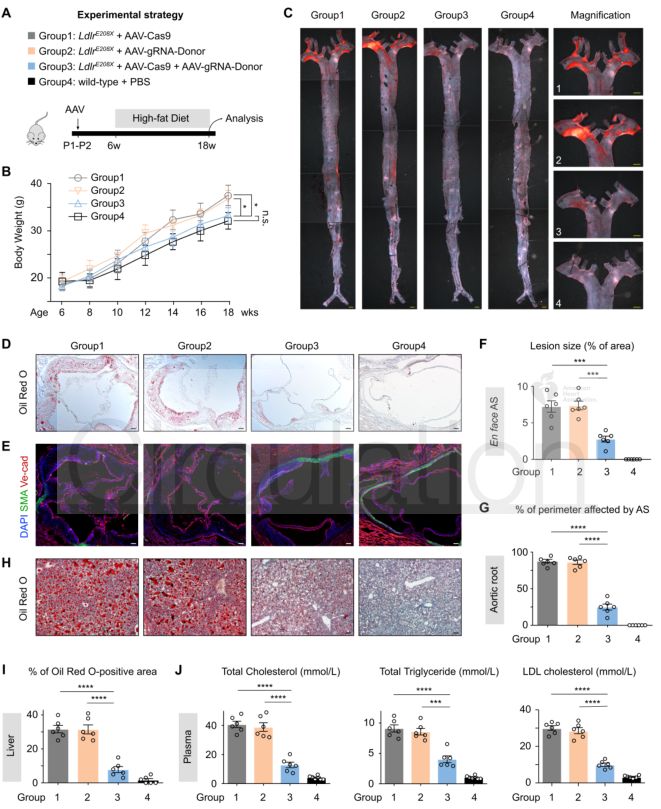
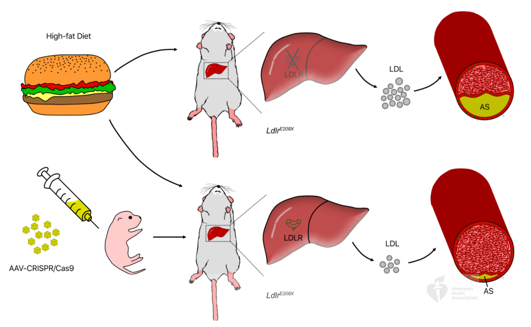
Innovation 创新点 1. 为人类家族性高胆固醇血症发病机制的研究建立了一种新的模型:含E208X无义点突变的LdlrE208X小鼠。 2. 通过单次注射AAV-CRISPR/Cas9对LdlrE208X小鼠进行体内基因编辑,可以减少脂质积累并改善动脉粥样硬化。 背景介绍 家族性高胆固醇血症(FH)的特点是低密度脂蛋白胆固醇(LDL-C)水平显著升高和过早发生心血管疾病。FH是一种常染色体显性遗传病,具有基因剂量效应,由编码低密度脂蛋白受体(LDLR)、载脂蛋白B(APOB)或枯草溶菌素转化酶9(PCSK9)的基因突变引起的。其中,90%的FH是由LDLR突变导致的。LDLR突变可导致功能性LDLR的表达水平降低,肝脏对血液循环中LDL-C的清除能力下降,进而使血液循环中的LDL-C过量,从而导致动脉粥样硬化斑块的发生和发展。动脉粥样硬化的严重程度与肝组织中LDLR的表达水平和活性密切相关。 纯合子FH(HoFH)的发病率约为百万分之一,可在婴幼儿时期就迅速发展为严重的动脉粥样硬化和心血管疾病,并导致死亡。杂合子FH患者(HeFH)具有功能性LDLR蛋白,因此目前的FH药物治疗(例如MG-CoA还原酶抑制剂(他汀类))通常只对HeFH有效,而高强度他汀类药物和PCSK9抑制剂对HoFH的治疗效果非常有限。这些差异表明即使低水平的LDLR表达和活性也可以显著影响FH的严重程度和发展速度。针对HoFH,现有的治疗手段包括LDL血浆置换及肝移植等,费用昂贵且存在一定风险,因此继续寻找和探索新的治疗方法具有重要意义。 关于家族性高胆固醇血症临床特征及相关基因检测的更多介绍,详见(点击查看原文): 成簇规律间隔的短回文重复序列(CRISPR)和其相关核酸内切酶(Cas)是近些年来发现和兴起的一种基因编辑技术,以其高效性和简便性广泛应用于不同物种的细胞基因编辑、动物模型构建和致病基因治疗等方面,极大地促进了生物学和医学研究发展。腺相关病毒(AAV)由于其高安全性以及稳定长效表达,被视为最有前景的基因治疗载体。利用AAV进行的基因治疗目前已被批准用于80多种疾病,并已用于临床试验。利用基因治疗人类遗传疾病是近年来医学生物领域的热点课题。 本研究为了确定AAV介导的CRISPR/Cas9系统对体内体细胞进行基因编辑是否可治疗由Ldlr突变引起的FH。 研究方法及结果 研究人员根据已在FH患者中发现的LDLR基因E207X无义突变(提前产生终止密码子,导致LDLR蛋白无法正常表达),利用CRISPR/Cas9系统将其导入小鼠受精卵进行打靶(图1),通过后续传代交配,成功构建LdlrE208X小鼠(纯合子),并通过基因测序、反转录PCR、Western blot和免疫荧光染色等方法进行了验证。结果发现携带纯合突变的LdlrE208X小鼠(n=6)经高脂膳食喂养后,肝脏中无LDLR蛋白表达,表现为严重的动脉粥样硬化表型(图2),与人类的HoFH患者表现类似。 图1. LdlrE208X敲入小鼠的突变策略。 图2. 高脂膳食喂养后LdlrE208X小鼠主动脉动脉粥样硬化病变的油红O染色图像及血浆总胆固醇、总甘油三酯、低密度脂蛋白(LDL)胆固醇水平对比。 随后利用AAV将CRISPR/Cas9系统(AAV-CRISPR/Cas9)送入LdlrE208X小鼠(n=6)体内,通过小向导RNA(sgRNA)引导Cas9蛋白至特定DNA位点后,利用同源重组修复(HDR)来矫正部分肝细胞的Ldlr突变,并部分恢复其LDLR蛋白的表达(n=6)。与对照组(n=6)相比,sgRNA的AAV-CRISPR/Cas9组(每组6只)的血清总胆固醇、总甘油三酯和LDL-C均显著降低,且主动脉粥样硬化斑块更小,巨噬细胞浸润程度更低,LdlrE208X小鼠肝脏脂肪蓄积得到有效降低(图3和图4)。同时CRISPR/Cas9系统的脱靶效应和一些免疫指标均显示,成体小鼠体内并未发现明显的脱靶及免疫排斥反应,支持了此次基因编辑治疗的有效性和安全性。 图3. AAV-CRISPR/Cas9治疗后LdlrE208X小鼠中LDLR表达的部分恢复和动脉粥样硬化的改善。 A. 腺相关病毒(AAV)注射、高脂饮食喂养及分析的实验策略。B. 各组不同时期的体重。C. 主动脉动脉粥样硬化病变的油红O染色图像。D. 小鼠主动脉根部油红O染色图像。E. 主动脉根部平滑肌肌动蛋白(SMA)和Ve-cad的免疫染色。F. 各组动脉粥样硬化病变面积的量化。G. 各组动脉粥样硬化(AS)对主动脉周长的影响。H. 肝切片油红O染色图像。I. 肝切片油红O阳性区的定量。J. 小鼠血浆总胆固醇、总甘油三酯、低密度脂蛋白胆固醇水平对比。 图4. AAV-CRISPR/Cas9治疗后LdlrE208X小鼠的部分恢复及动脉粥样硬化表型改善的示意图。 以上结果表明,通过AAV-CRISPR/Cas9系统进行的体内基因编辑可能是一种有效的HoFH治疗方法,同时可能有助于改善当前降脂药物的疗效。此外也证明CRISPR/Cas9技术可作为一种应用于人类遗传病治疗的潜在工具,但在进入临床实验前还必须进行更多研究测试(如大型动物试验等)。 结论 本研究表明在体内用AAV-CRISPR/Cas9介导的Ldlr基因校正可部分恢复LDLR的表达,有效改善Ldlr突变小鼠的动脉粥样硬化表型,为FH患者提供了一种潜在的治疗方法。随着全基因组测序成本的降低,对家庭成员和胎儿进行筛查将变得更加普遍。因此,在疾病进展的早期阶段诊断FH,有可能实现通过基因校正进行早期治疗。将来,AAV-CRISPR/Cas9系统可能用于校正遗传性心血管病中的一些生殖细胞基因突变,从而改善甚至修复疾病。 【参考文献】 Huan Zhao, et al. In Vivo AAV-CRISPR/Cas9-Mediated Gene Editing Ameliorates Atherosclerosis in Familial Hypercholesterolemia. Circulation. 2020, 141: 67-79.