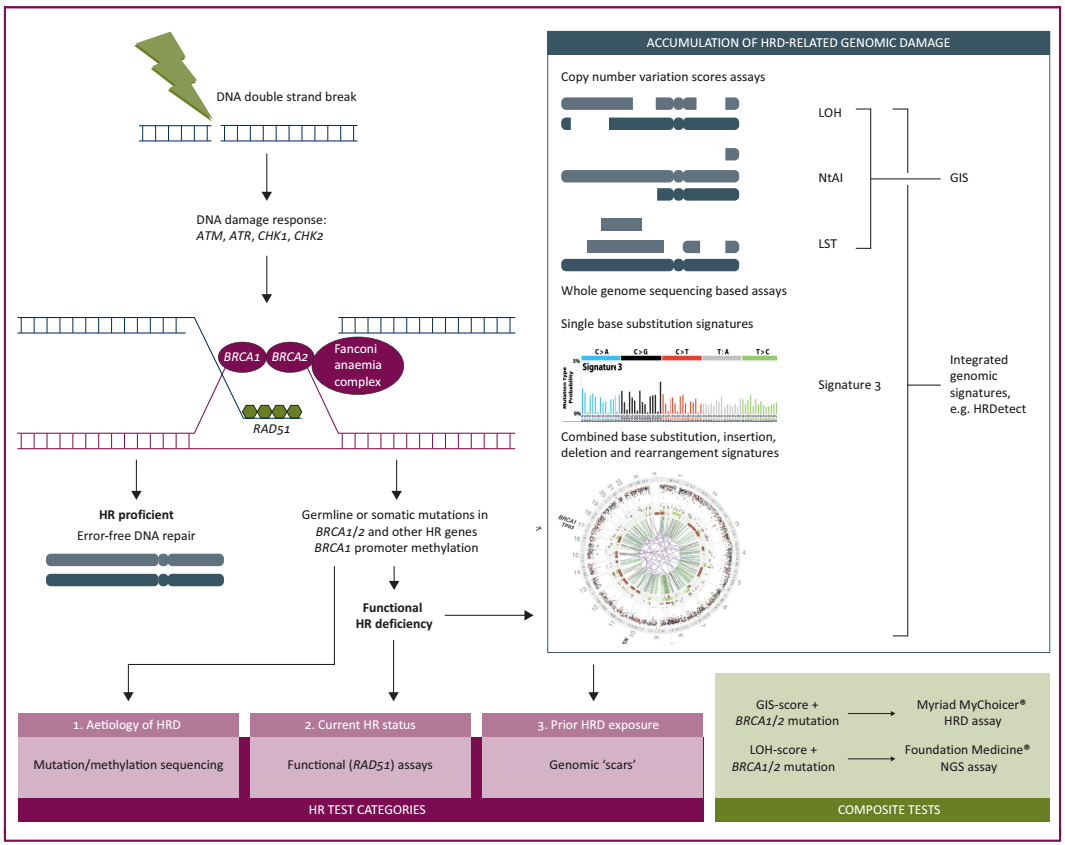
每年,全球接近25万女性被诊断出患有卵巢、输卵管或腹膜癌的高级别浆液性癌(high-grade serous carcinoma, HGSC)。同源重组修复缺陷(homologous recombination repair deficiency, HRD)是HGSC的常见特征,具有HRD的HGSC患者表现出独特的临床表型,包括对铂类化疗有较好的反应和对PARP抑制剂(PARPi)的敏感性。HRD检测可进一步扩大PARPi的获益人群,但目前的检测方法多样且缺乏标准化,其临床应用仍存在争议。为解决这一问题,欧洲肿瘤内科学会(ESMO)近期发布了卵巢癌同源重组缺陷和PARP抑制剂获益的预测性生物标志物检测建议。该共识的三个主要目标是:(1)定义“HRD检测”,(2)现有HRD检测方法的临床有效性评估,(3)HRD检测在临床HGSC管理中的应用。
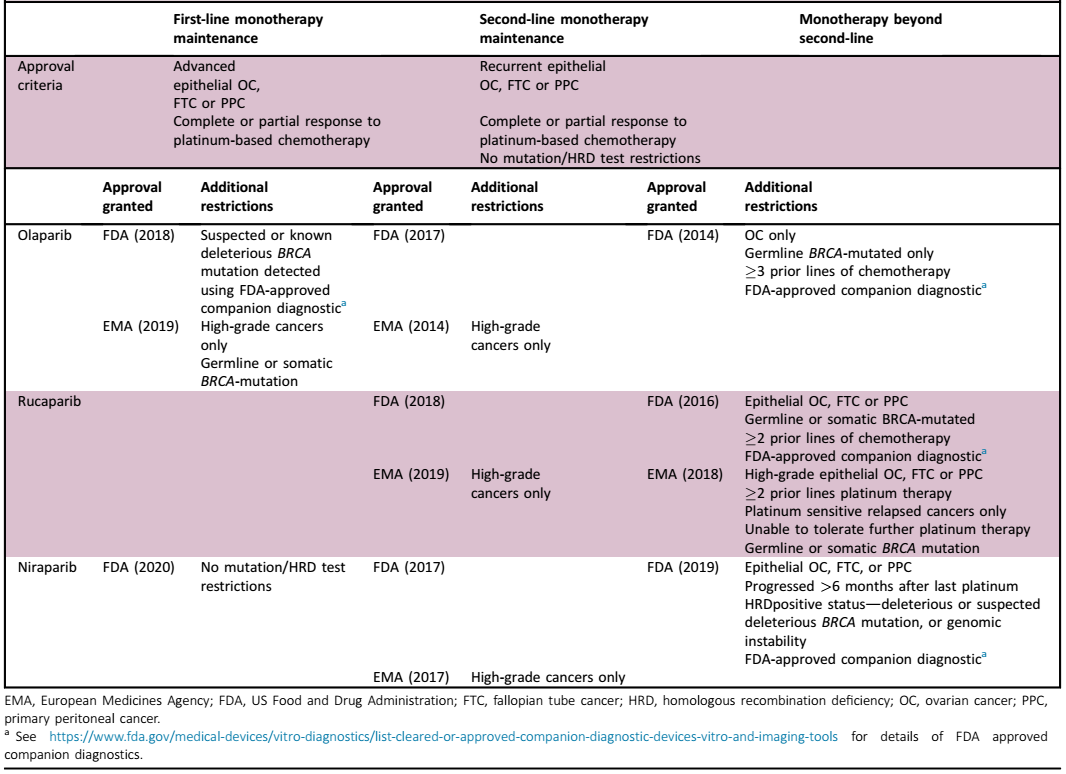
01 什么是HRD? HRD检测的专业术语 1)同源重组修复(Homologous recombination repair, HRR):一种DNA重组形式,常用于修复DNA双链断裂。HRR主要作用于细胞周期的S期和G2期,是一个保守的过程,在受损部位恢复原始DNA序列。在HRR过程中,切除DSB周围的部分DNA序列,揭示单链DNA (ssDNA)区域。DNA重组酶RAD51结合ssDNA并侵入同源姐妹染色单体上的DNA序列,将其作为DSB位点合成新DNA的模板。介导HRR的关键蛋白包括BRCA1、BRCA2、RAD51、RAD51C、RAD51D和PALB2编码的蛋白。 (2)同源重组缺陷(Homologous recombination deficiency, HRD):受阻的HRR导致的DNA修复缺陷。在肿瘤中,这通常是由BRCA1、BRCA2、RAD51C、RAD51D或PALB2功能缺失性突变、BRCA1基因启动子高甲基化(导致BRCA1表达降低)或一系列尚不明确的原因所致。HRD可以通过多种方式定义,例如,通过使用测量DSB的保守修复与非保守修复,HRD导致的突变特征或细胞无法将DNA重组酶RAD51重新定位到位点的实验分析来定义DNA损伤。HRD的特征还在于其对PARP抑制剂、拓扑异构酶抑制剂或铂类药物的敏感性,尽管对这些药物敏感还存在其他原因(如核苷酸切除修复(NER)缺陷)。“HRD”一词通常与“BRCAness”一词互换使用,后者描述了更广泛的概念,“BRCA胚系突变的肿瘤(gBRCAm表型)的分子、组织学、临床和表型特征,还包括HRD(但并非唯一)对PARP抑制剂、拓扑异构酶抑制剂和铂类药物具有敏感性”。 (3)HRD 肿瘤:表现出HRD的肿瘤。HRD在卵巢癌、前列腺癌、胰腺癌和乳腺癌中高发,其中BRCA1、BRCA2、RAD51、RAD51C、RAD51D或PALB2缺陷最为常见。 (4)同源重组能力(Homologous recombination proficiency, HRP):细胞/肿瘤细胞能够通过HRR有效修复DNA损伤。通常与对PARP抑制剂、拓扑异构酶抑制剂或铂类药物的初级或获得性耐药有关。 (5)PARP抑制剂(PARPi):PARPi是PARP蛋白家族的小分子抑制剂,通过多种DNA损伤反应通路在DNA修复中发挥关键作用,而HRD细胞表现出对PARP活性的更大依赖,以维持细胞存活。PARP抑制剂单药选择性杀死BRCA缺陷细胞的发现是开发肿瘤合成致死方法的一个关键。PARP抑制剂将PARP1蛋白诱捕到DNA单链断裂的位点上。当DNA复制机制遇到捕获的PARP1时,它会导致复制叉停滞,折叠并产生双链断裂,而双链断裂则无法在具有HRD的细胞(如BRCA突变的细胞)中修复。 02 HRD的检测方法 HGSC中HRD的最典型特征是BRCA1和BRCA2基因(BRCA)的胚系或体细胞突变,它们分别编码1型和2型乳腺癌易感蛋白,检出率分别为12%-15%和5%-7%。但是,现在有明确的证据表明,HRD可以通过胚系和体细胞突变,或更广泛的同源重组修复(HRR)相关基因的甲基化或其他尚未确定的机制产生。因此,HRD检测方法主要有三种:(i)与HRR通路相关的基因,可识别导致HRD的特定原因;(ii)基因组“疤痕”或突变标记,评估在HRD肿瘤中积累的体细胞突变模式,而不考虑潜在缺陷;(iii)可以实时读取HRD或HRP的功能分析(见图1)。 图1 同源重组修复缺陷(HRD)的检测方法 关于HRD检测方法的共识声明 (Level of agreement = 100%; total agreement) 1、HRR基因检测: ·BRCA突变检测包括胚系(LOEⅠ),肿瘤(结合胚系和体细胞)(LOEⅠ),体细胞(LOEⅠ/Ⅱ)都能识别出从PARPi治疗中获益最大的卵巢癌患者亚群,显示了良好的临床有效性。 ·目前还没有足够的证据证实单个或非BRCA HRR基因在预测PARPi反应中的临床有效性,需要进一步前瞻性的研究数据(LOEⅡ)。 ·目前还没有足够的证据证实BRCA1或RAD51C启动子甲基化预测PARPi获益的临床有效性,部分原因是对以往研究的分析有效性的担忧。 2、HRD基因组疤痕检测: ·纳入等位基因失衡分数(GIS or LOH)的HRD检测能识别BRCA野生型、铂敏感的肿瘤亚组,在某些情况下,这类患者可能从PARPi治疗中获得更大程度的益处(LOEⅠ)。 ·目前尚无足够的证据证实基于突变特征的全基因组测序在预测HGSC中的PARPi获益方面的临床有效性。 ·临床前证据表明,就鉴定HRD肿瘤而言,基于突变特征的全基因组测序可能比现有的基因组疤痕检测更好,因此应在存档的临床试验样本和/或预期的临床试验样本中确定其对PARPi的临床有效性。 3、HRD功能分析: ·目前尚无足够的证据证实HRD功能分析在预测PARPi的治疗反应方面的临床有效性,但这些临床前分析为探索HRD的实时评估提供了希望,应优先考虑其发展。功能分析、HRR基因和基因组检测共同使用是一个潜在的应用方向。 03 HRD检测的临床应用 关于HRD检测临床应用的共识声明 (Level of agreement = 100%; total agreement) ·对于一线维持治疗中,建议常规进行胚系和体细胞BRCA检测,识别出应接受PARPi治疗的HGSC患者(见表1)。 ·在一线维持治疗中,对于无BRCA突变的野生型HGSC患者,可考虑使用经过验证的基于基因组疤痕的HRD检测来确定PARPi的获益。 ·在一线维持治疗中,可考虑使用经过验证的基于基因组疤痕的HRD检测筛选出最不可能从PARPi治疗中获益的BRCA野生型患者亚组。 ·在对铂敏感的复发性HGSC患者的维持治疗中,考虑到维持治疗的风险和益处,可考虑使用BRCA突变检测和经过验证的基于基因组疤痕的HRD检测来预测PARPi获益的可能性。 表1获批用于妇科肿瘤的PARP抑制剂 参考文献: R E Miller , A Leary. ESMO recommendations on predictive biomarker testing for homologous recombination deficiency and PARP inhibitor benefit in ovarian cancer. Ann Oncol. 2020 Sep 28;S0923-7534(20)42164-7.