

近日,在IF87的国际顶级期刊《Nature Medicine》同期刊登2篇文章,聚焦突变特异性基因编辑在肥厚型心肌病治疗前景中的新突破。Chai等人和Reichart等人报告了基于基因编辑的新精准疗法的临床前研究,以期在症状发生前纠正导致肥厚型心肌病的致病变异MYH7 c.1208G>A(p.R403Q),实现“一次治疗,永久治愈”的长远目标。


在《Base editing correction of hypertrophic cardiomyopathy in human cardiomyocytes and humanized mice》文章中,确定了一个腺嘌呤碱基编辑器(ABEs)和单链向导RNA(sgRNA)系统,在选定的位点以最小限度的旁观者编辑(bystander editing)和脱靶编辑可以有效地纠正MYH7基因上的p.R403Q致病变异(PV)。结果表明,在源自肥厚型心肌病(HCM)患者的诱导性多能干细胞(iPSc)心肌细胞和HCM人源化小鼠模型中,碱基编辑成分的传递可挽救HCM的病理表现。该研究证明了碱基编辑在治疗遗传性心脏病方面的潜力,并促进了腺嘌呤碱基编辑器疗法的进一步发展,以纠正导致心脏病的单基因变异。 最常见的遗传性心脏病是肥厚型心肌病(HCM),它是由编码心肌肌小节相关蛋白的基因变异引起,并导致异常的心肌肥厚。HCM的并发症包括心力衰竭、心律失常和心原性猝死。MYH7(编码β-肌球蛋白)的显性负向c.1208G>A(p.R403Q)变异是一种常见且研究充分的PV,可导致心脏收缩力增加和HCM发病。
HCM患者iPSCs的ABE纠正效率
为了将ABEmax-VRQR和h403_sgRNA系统应用于疾病模型,研究人员从2名携带MYH7403/+ PV(HCM1403/++和HCM2403/+)的HCM患者中获得了人类iPSCs。通过ABEmax-VRQR-P2a-EGFP和h403_sgRNA的质粒转染、GFP+细胞荧光激活细胞分选来纠正MYH7403/+变异(图1a)。通过高通量测序(HTS),尽管有98%-99%的靶点编辑,但在使用生物信息学工具CRISPOR后确定的8个检测候选脱靶基因座的所有58个腺嘌呤碱基上,脱靶DNA编辑极少甚至没有(0.12%或更少)(图1b)。结果表明,具有ABEmax-VRQR的h403_sgRNA可以有效且特异性地纠正目标致病性错义变异,在检测的脱靶位点仅需极少的旁观者编辑和很少或没有DNA编辑。
ABE编辑患者来源iPSC-CMs的功能分析
为了研究基因编辑纠正是否能减少HCM患者的超收缩力的产生,研究人员将iPSC-CMs以单细胞密度放置在柔软的聚二甲基硅氧烷表面上,记录心肌细胞(CMs)收缩的高帧率视频并计算峰值收缩力(图1c)。由于先前的研究表明p.R403Q HCM变异导致ATP消耗增加和细胞代谢改变,接着又通过基因编辑纠正后的代谢通量测定评估细胞能量学的变化(图1d)。结果表明,在人类HCM的CMs中,PV的纠正足以挽救超收缩表型并恢复正常的细胞能量。
图1. 基于碱基编辑纠正的HCM患者iPSC-CM的功能分析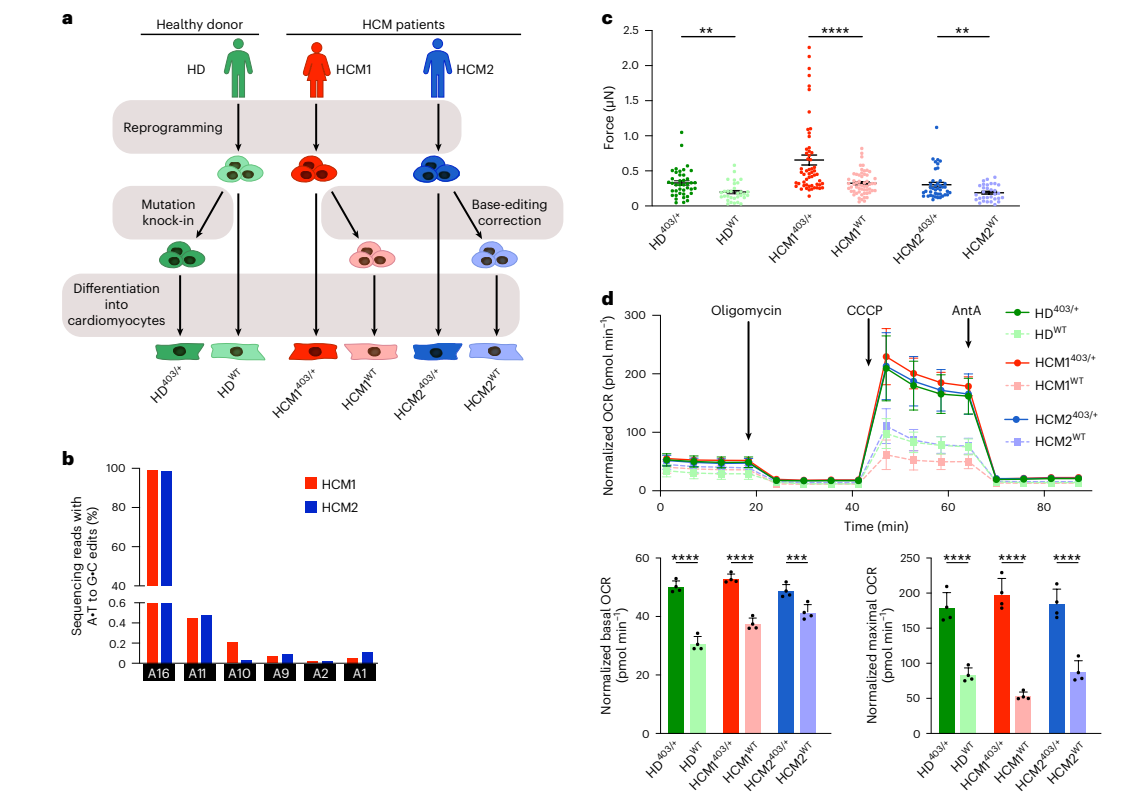
HCM生物学人源化小鼠模型的建立
与人类心脏中主要表达的β-肌球蛋白重链异构体不同,成年小鼠心脏主要表达α-肌球蛋白重链异构体,由MYH6编码。以往的HCM小鼠模型都是用MYH6突变直接替代MYH7突变以解释表达差异,但这二者在蛋白编码区并不是完全相同的,因此用于人类基因组的sgRNA和编辑策略无法直接应用至小鼠模型。为了使用人类序列特异性碱基编辑策略进行临床前研究,研究人员建立了一个人源化小鼠模型,在小鼠MYH6基因中包含MYH7 c.1208G>A(p.R403Q)人类错义变异,该基因也具有PV上游和下游的至少21个核苷酸的人类DNA序列同一性,以便检测人类基因组特异性CRISPR策略。另一个MYH6等位基因包含未修饰的小鼠基因组序列。这种人源化小鼠模型(MYH6h403/+)反映了先前描述的MYH6 p.R403Q小鼠模型的表型。
人类HCM小鼠模型的体内ABE治疗
研究人员首先试图通过挽救MYH6h403/h403小鼠来验证双AAV9 ABE系统的效率,这些小鼠在出生后一周内就会死亡。值得注意的是,目前没有报道人类患者具有纯合子基因型。用生理盐水、低剂量(4×1013 vg kg-1)或高剂量(1.5×1014 vg kg-1)的AAV9(低剂量共为8×1013 vg kg-1,高剂量共为3×1014 vg kg-1)向P0(出生后第0天)的MYH6h403/h403幼崽胸腔内注射,并监测其发育情况。结果MYH6h403/+和MYH6WT小鼠在断奶后存活并进入成年。高剂量小鼠心脏的互补DNA(cDNA)的Sanger测序表明,在转录水平上致病性核苷酸纠正了35%,这表明双AAV9 ABE系统能够在心脏中进行基因编辑(图2)。 由于MYH7 p.R403Q变异仅以杂合形式存在于人类患者中,接下来又设置了双AAV9 ABE系统来预防MYH6h403/+小鼠中HCM疾病的发生。结果发现,与MYH6WT对照组相比,MYH6h403/+小鼠的HCM特征增加,包括舒张期左室前壁(LVAW)厚度增加和舒张期左室后壁(LVPW)厚度增加。这些小鼠在舒张期和收缩期的左室内径减小,左室射血分数(EF)和左室缩短分数(FS)增加。MYH6h403/+小鼠的心室壁厚度增加,心室直径减小以及正常高值FS,这与人类患者的临床进展一致。这些数据表明,双AAV9 ABE系统治疗足以预防HCM介导的心脏病理性重塑的发生(图2)。
图2. 对Myh6h403/+小鼠进行双AAV9 ABE系统编辑预防HCM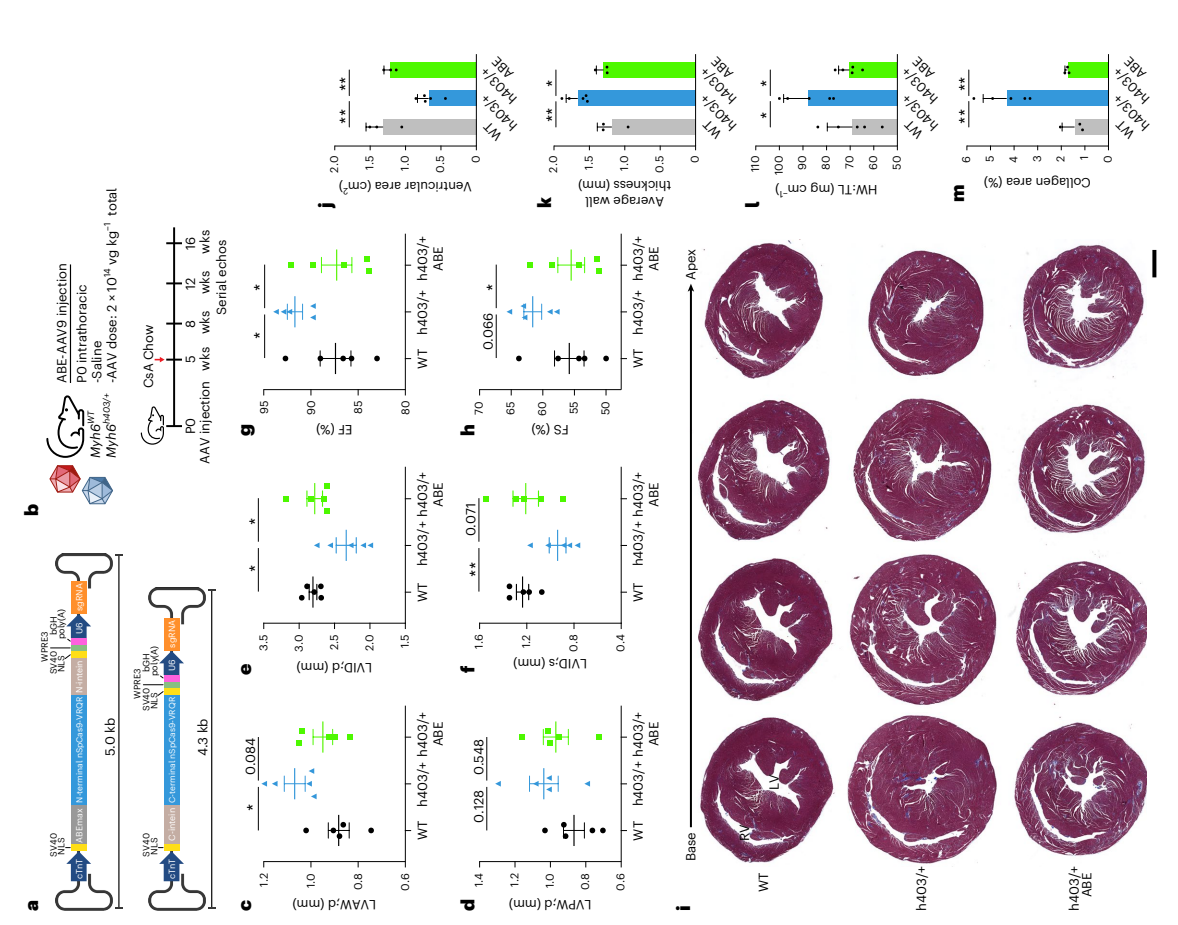
而在《Efficient in vivo genome editing prevents hypertrophic cardiomyopathy in mice》文章中,研究人员构建了可模拟人类肌球蛋白R403Q突变的小鼠模型,其病理特征和人类疾病表现类似,包括左心室肥大、心室腔缩小以及心肌纤维化。基于该动物模型,研究人员评估了两种不同的基因疗法——腺嘌呤碱基编辑器(ABE8e)和由AAV9递送的强效Cas9核酸酶,来预防携带杂合HCM致病变异肌球蛋白R403Q的小鼠发生心脏病变。利用单剂量的AAV9双载体,每个载体携带一半的RNA引导的ABE8e,纠正了≥70%的心室心肌细胞的致病变异,并保持了持久且正常的心脏结构和功能。额外的剂量虽然提升了心房处的编辑效率,但也增加了旁观者编辑现象的发生。RNA引导的Cas9核酸酶的AAV9递送有效地灭活了致病等位基因,但由于剂量依赖性的毒性,需要一个狭窄的治疗窗口来维持健康。这些临床前研究表明,单剂量基因疗法在纠正或沉默致病变异、预防HCM发展方面具有相当大的潜力(图3)。
图3. 致病性变异R403Q的AAV9-Cas9沉默和R403Q-129SvEv小鼠的心脏功能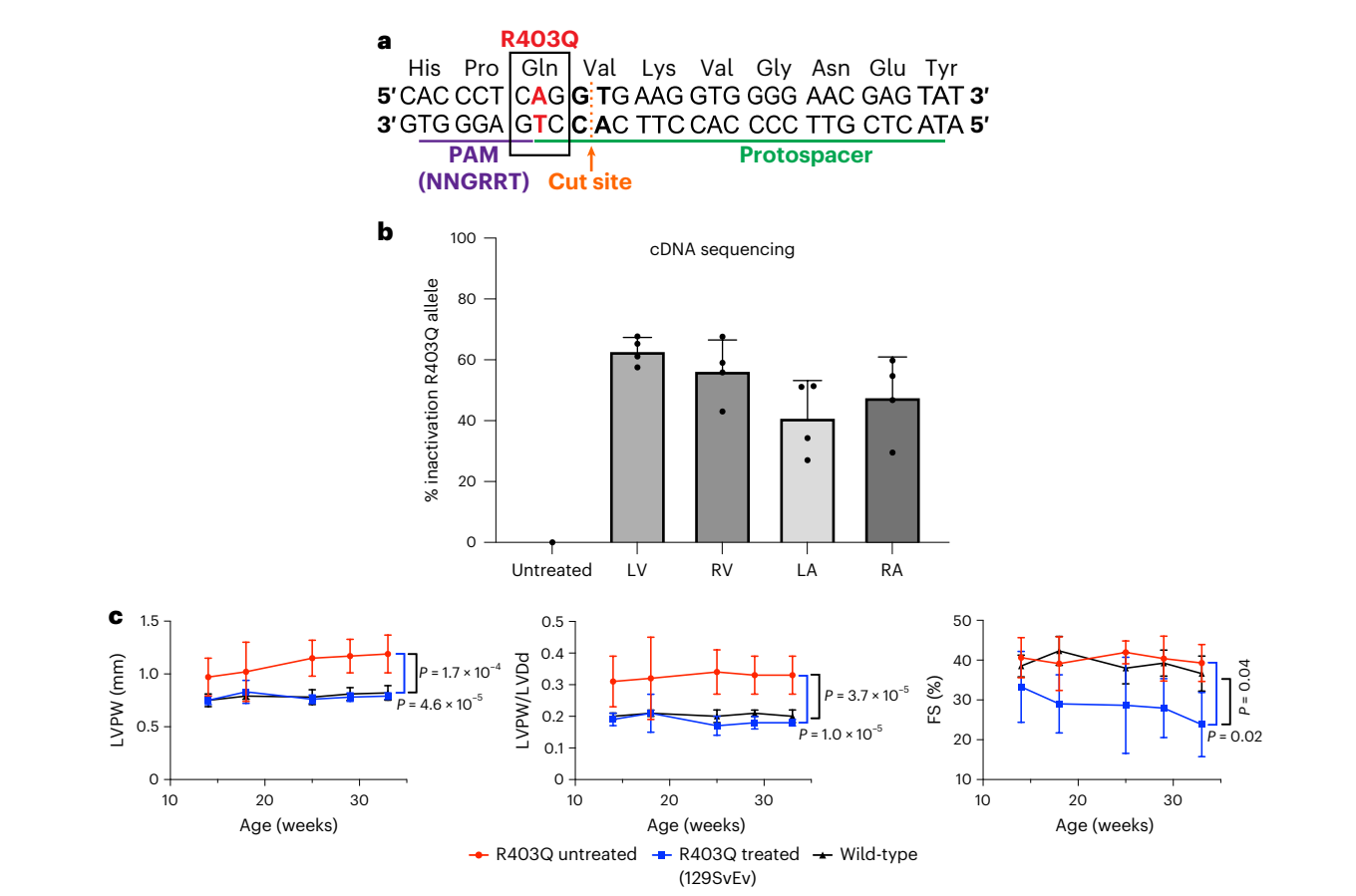
以上两项基于基因编辑的新精准疗法的临床前研究,为HCM模型的成功基因编辑提供了希望,虽然将其转化为人类患者还需面临各种挑战,但单剂量明确的治疗方法不仅适用于HCM,也适用于基因敲除或过度表达策略不适用的众多其他遗传性综合征,因此是一个非常值得追求的目标。在未来,基因编辑应用于临床的精准治疗指日可待!
参考文献
[1] Chai AC, Cui M, Chemello F, et al. Base editing correction of hypertrophic cardiomyopathy in human cardiomyocytes and humanized mice. Nat Med, 2023 Feb; 29(2): 401-411. [2] Reichart D, Newby GA, Wakimoto H, et al. Efficient in vivo genome editing prevents hypertrophic cardiomyopathy in mice. Nat Med, 2023 Feb; 29(2): 412-421. 往期回顾 《心肌病中的致病变异会损害细胞组成和单细胞转录?Science 最新研究给你答案》