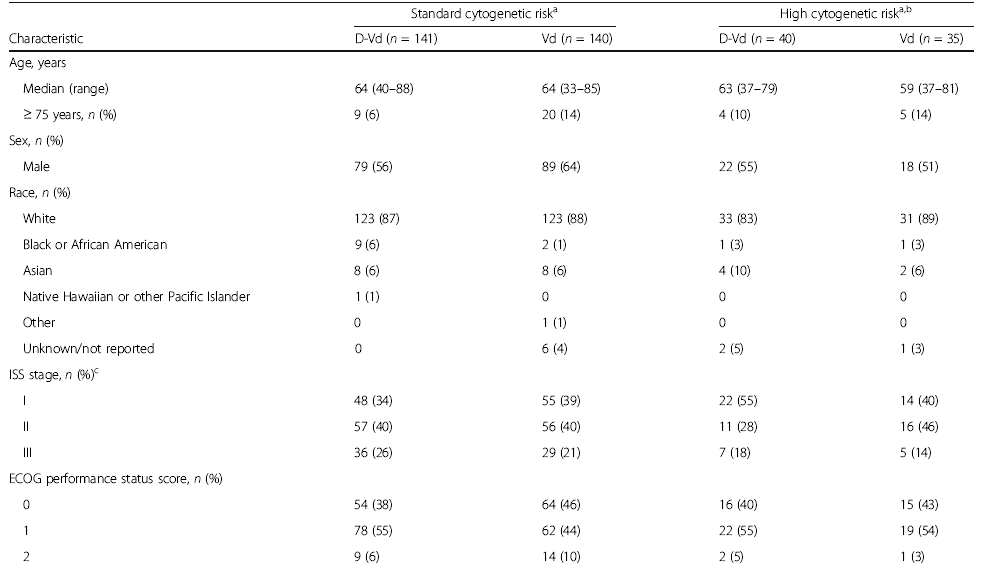
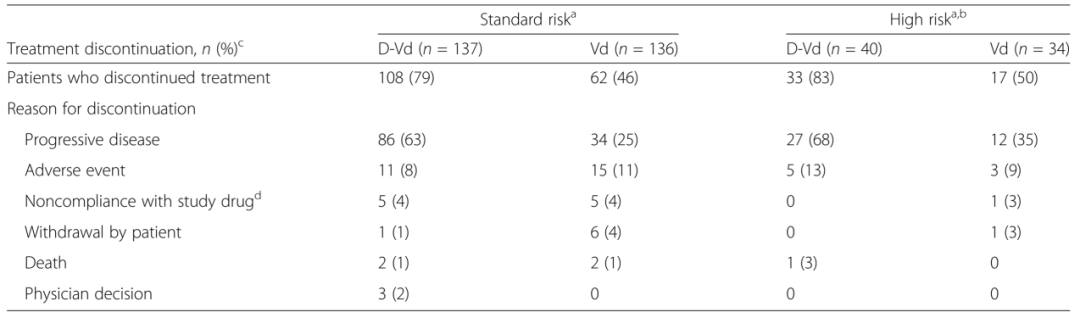
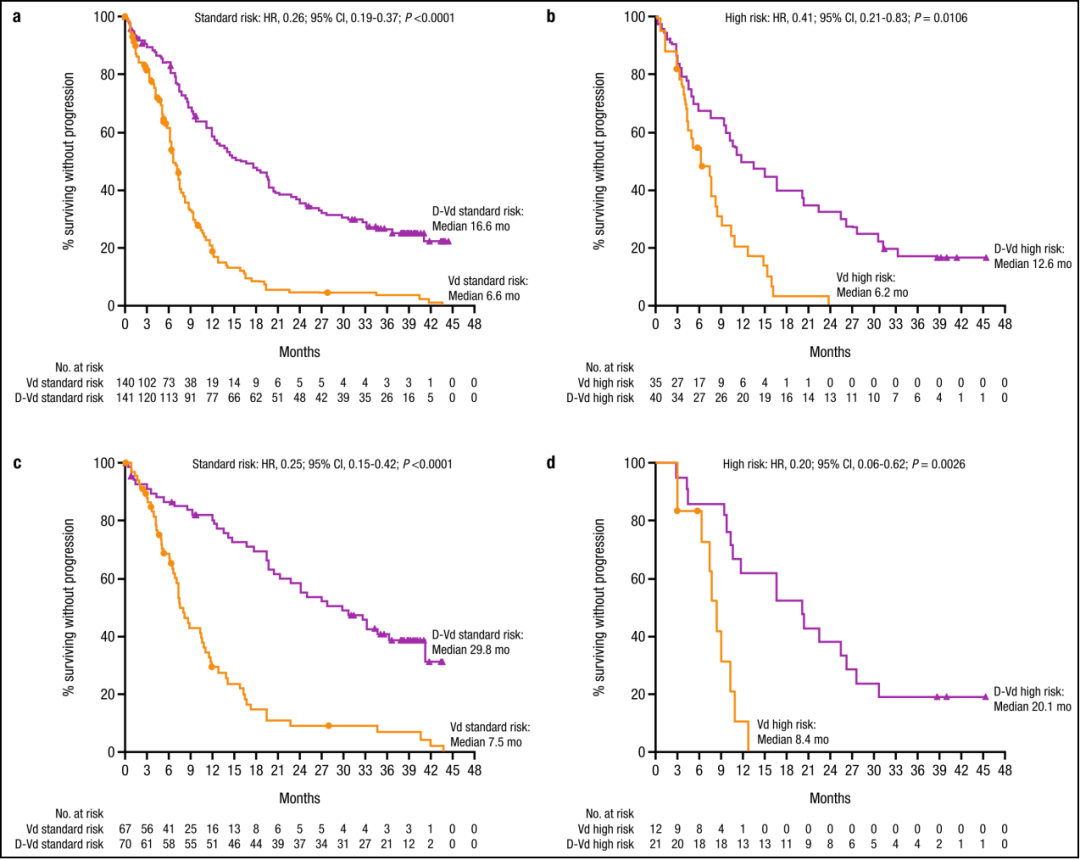
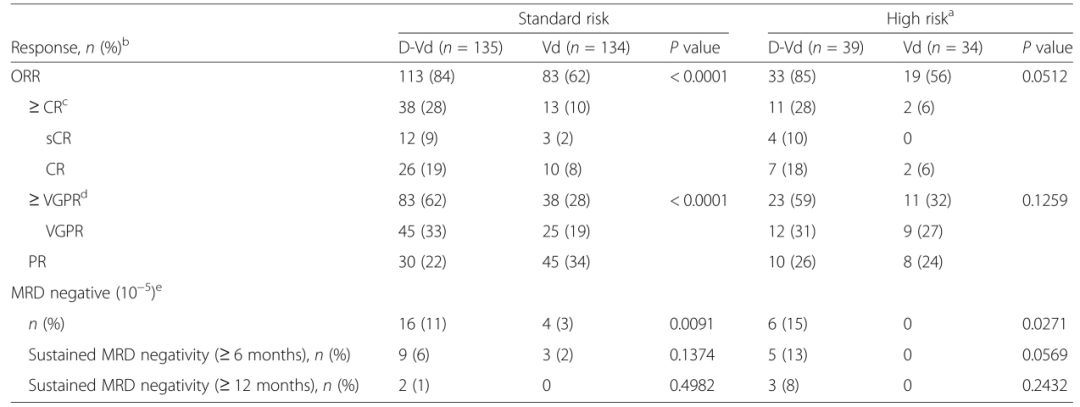
前言
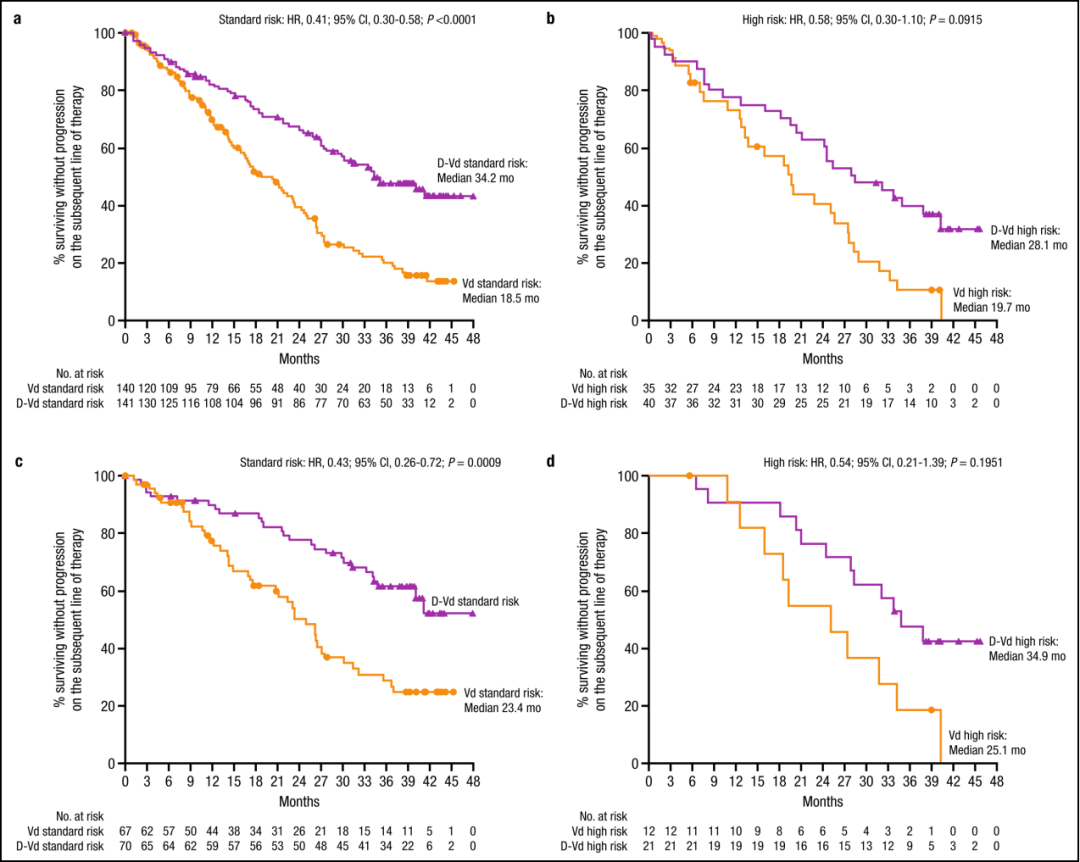
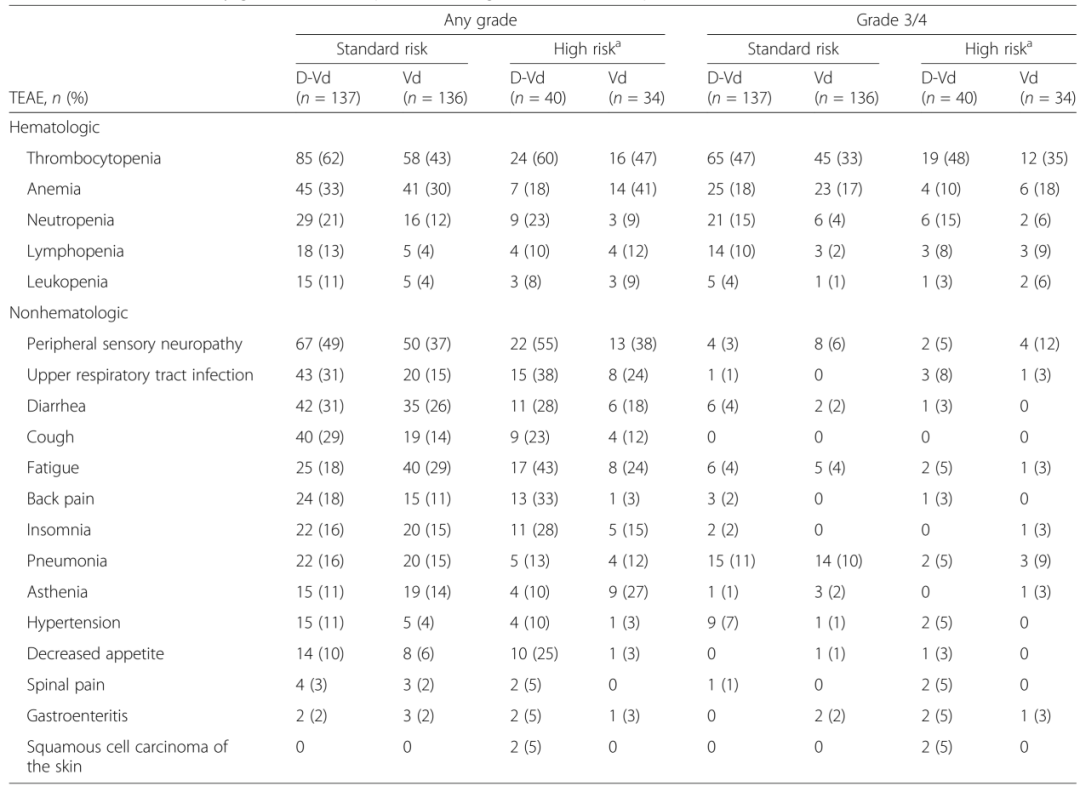
多发性骨髓瘤(Multiple myeloma,MM)是一种以骨髓中积聚浆细胞为特征的恶性肿瘤,可导致骨质破坏和骨髓衰竭。尽管MM病变在形态学上可能相似,但根据细胞遗传学可将患者分为不同的危险组。国际骨髓瘤工作组建议将高危细胞遗传学异常定义为至少伴有t(4;14)、t(14;16)或del17p任意一个。高危细胞遗传学异常的MM患者预后较差。Weisel K等进行了一项基于细胞遗传学的CASTOR亚组分析,评估达雷木单抗+硼替佐米+地塞米松治疗复发难治性多发性骨髓瘤患者(RRMM)40个月的疗效和安全性。结果显示,与Vd治疗组(硼替佐米+地塞米松)相比,DVd治疗组(达雷木单抗+硼替佐米+地塞米松)的中位无进展生存期(progression-free survival, PFS)显著延长,微小残留病(minimal residual disease,MRD)阴性和持续MRD阴性患者的比例显著升高;DVd治疗组与Vd治疗组的安全性相似。 患者的临床特征与治疗方式 498名患者随机接受DVd治疗和Vd治疗,DVd组251名,Vd组247名。356名(71%)患者接受细胞遗传学检测,283名(57%)采用FISH检测,217名(44%)采用核型分析,144名(29%)患者同时使用两种方法检测。表1展示以细胞遗传学风险状态为基础的患者人口统计学、基线疾病和临床特征。在达到完全缓解(complete response,CR)或疗效更好的患者中,有15(16%)名患者未进行MRD评估。 表1 患者的人口统计学、基线疾病和临床特征 DVd 达雷木单抗/硼替佐米/地塞米松,Vd硼替佐米/地塞米松,ISS国际分期系统,ECOG东部肿瘤协作组,ASCT自体干细胞移植,PI蛋白酶体抑制剂,IMiD免疫调节药物,FISH荧光原位杂交 注:由于四舍五入百分比可能不等于100%。a. 基于FISH/核型检测;b. 具有t (4;14), t(14;16),或del17p异常的高危细胞遗传学患者;c. ISS阶段是基于血清β2-微球蛋白和白蛋白的结合;d. 具有≥2个t(4;14),t(14;16),或del17p异常的患者。 在标危和高危细胞遗传学异常亚组中,分别有170(62%)和50(68%)名患者中止治疗(表2)。因病情进展而停药的Vd治疗患者中,标危亚组9名(共34名),高危亚组2名(共12名),这些患者随后接受达雷木单抗单药治疗。 表2 中止治疗患者的细胞遗传学风险 a. 基于FISH/核型检测;b. 具有t (4;14), t(14;16),或del17p异常的高危细胞遗传学患者;c. 安全人口;d. 治疗结束前“患者中止治疗”的原因。 药物有效性评估 在平均40个月的随访后,与Vd治疗组相比,DVd治疗组患者的中位PFS显著延长(标危:16.6m vs. 6.6m,P<0.0001,图1a;高危:12.6m vs. 6.2m,P=0.0106,图1b)。既往接受过至少1种治疗的患者中,相比Vd,DVd治疗组患者的中位PFS显著延长(标危:29.8m vs. 7.5m,P<0.0001,图1c;高危:20.1m vs. 8.4m,P = 0.0026,图1d)。 ITT/生物标记风险人群(ITT人群中符合生物标记风险评估标准的患者)中的PFS:a标危细胞遗传学异常患者b高危细胞遗传学异常患者。既往1种治疗方案的PFS患者:c标危细胞遗传学患者和d高危细胞遗传学异常患者。CI,置信区间;DVd,达雷木单抗加硼替佐米/地塞米松;HR,风险比;ITT,意向治疗;PFS,无进展生存率;Vd,硼替佐米/地塞米松 DVd治疗组较Vd治疗组有更高的总缓解率(overall response rate, ORR)(标危:84% vs. 62%,P<0.0001;高危:85% vs. 56%,P = 0.0512),包括完全缓解或更好的响应(标危:28% vs. 10%;高危:28% vs. 6%),以及非常好的部分缓解(very good partial response,VGPR)或更好的响应(标危:62% vs. 28%,P<0.0001;高危:59% vs. 32%,P = 0.1259;表3)。相比Vd,DVd患者达到VGPR的中位时间更短(标危:3.5m vs.未评估,P<0.0001;高危:3.5m vs. 6.2m;P = 0.1004)。 在DVd治疗组中,MRD阴性患者(<10-5)的比例高于Vd组(标危:11% vs. 3%,P=0.0091;高危:15% vs. 0%,P=0.0271)。与Vd组相比,DVd治疗组患者的MRD阴性持续至少6个月,与细胞遗传学风险状态无关。DVd组中有2例(1%)标危患者和3例(8%)高危患者的MRD阴性持续至少12个月,而Vd组两种亚组均无MRD阴性。 表3标危和高危细胞遗传学异常患者的缓解率和MRD阴性比例 a. 具有t (4;14), t(14;16),或del17p异常的高危细胞遗传学患者; b. 响应评估人口;c. ≥CR=sCR+CR;d. ≥VGPR=sCR+CR+VGPR; e. ITT人口(标危:DVd,n = 141;Vd,n = 140;高危:DVd,n = 40;Vd, n = 35)。 与Vd组相比,DVd治疗组患者的后线治疗中位PFS延长(PFS on the subsequent line of therapy)(标危:34.2m vs. 18.5m,P<0.0001,图2a;高危:28.1m vs. 19.7m,P = 0.0915,图2b)。在既往接受过1种治疗的患者中,DVd治疗组患者中位PFS2较Vd组患者延长(标危:未评估 vs. 23.4m,P = 0.0009,图2c;高危:34.9m vs. 25.1m,P = 0.1951,图2d)。 图2 基于细胞遗传风险状态的PFS2值 ITT/生物标记风险人群(ITT人群中符合生物标记风险评估标准的患者)中的PFS2:a标危细胞遗传学异常患者b高危细胞遗传学异常患者。既往1种治疗方案的PFS2患者:c标危细胞遗传学患者和d高危细胞遗传学异常患者。CI,置信区间;DVd,达雷木单抗加硼替佐米/地塞米松;HR,风险比;ITT,意向治疗;PFS,后续治疗的无进展生存率;Vd,硼替佐米/地塞米松 在数据分析期间,高危细胞遗传学异常的患者中,DVd治疗组有21例死亡,Vd治疗组有23例死亡。总生存期数据尚不成熟,随访仍在进行中。 药物安全性评估 表4总结了至少25%的患者治疗期间出现的所有不良事件(Treatment Emergent Adverse Event, TEAE),以及至少5%的患者治疗期间出现的3/4级不良事件。由于药物不良反应导致的停药率在DVd组和Vd组相似(标危:8% vs. 10%;高危:10% vs. 9%)。 表4 最常见的是任意级(25%的患者)和3/4级(5%的患者)治疗诱发的不良事件 展望与小结 达雷木单抗是一种人源性IgGκ单克隆抗体,能靶向CD38并通过多种途径发挥抗肿瘤作用。达雷木单抗被批准作为单药或联合治疗复发难治性MM患者,1)与硼替佐米/地塞米松(Vd)或来那度胺/地塞米松(Rd)联合治疗既往接受过至少1种治疗方案的MM患者,2)与泊马度胺/地塞米松联合治疗既往接受过至少2种治疗方案(包括来那度胺和蛋白酶体抑制剂)的MM患者,3)与硼替佐米/美法仑/强的松联合或与来那度胺/地塞米松联合用于新诊断的不适合自体干细胞移植的MM患者,4)与硼替佐米/沙利度胺/地塞米松联合用于新诊断的适合移植的MM患者,5)单药治疗用于既往接受过至少三种方案治疗、或对蛋白酶抑制剂和免疫调节剂均无效的MM患者。 CASTOR亚组分析显示,在平均40个月的随访后,无论细胞遗传风险状况如何,DVd治疗组患者在PFS方面的获益显著优于单纯Vd治疗组。值得注意的是,高危细胞遗传异常患者接受DVd治疗可获得MRD阴性,这表明靶向CD38联合其他标准治疗方案有助于改善该群体的不良预后。在不远的将来,针对高危RRMM患者的治疗方案选择仍然存在分歧,潜在的治疗方案包括达雷木单抗联合泊马度胺、卡非佐米或硼替佐米、来那度胺和地塞米松。 参考文献 Weisel K, Spencer A, Lentzsch S, et al. Daratumumab, bortezomib, and dexamethasone in relapsed or refractory multiple myeloma: subgroup analysis of CASTOR based on cytogenetic risk[J]. Journal of Hematology & Oncology, 2020, 13(1): 1-11.