

急性淋巴细胞白血病(Acute lymphoblastic leukaemia,ALL)是儿童最常见的恶性肿瘤,也见于成人。ALL疾病风险分层和强化化疗方案的发展极大地改善了患者的临床结局,尤其是儿童患者(1-14岁)。然而,年龄偏大(≥40岁)和复发难治性急性ALL患者的预后仍然较差。目前新的免疫治疗策略如单克隆抗体和嵌合抗原受体T细胞免疫疗法(CAR-T)等正在开发中。本文主要总结ALL的治疗策略,这些方案在未来几年有望改变ALL患者的治疗选择。
急性淋巴细胞白血病的一线治疗通常包括持续2 - 3年的四个阶段治疗:诱导、巩固、强化和长期维持(图1)。此外,还应给予预防中枢神经系统的针对性治疗。高危患者或持续MRD患者可选择异体造血干细胞移植。这种强化治疗策略可使儿童ALL的5年总生存期(overall survival, OS)达到90%,成人ALL预后较差,5年OS低于45%。通过借鉴儿科治疗方案的经验,已使年龄偏大的ALL患者(AYAs,50-60岁)的5年OS提高至50%及以上,在预后良好的亚组中可提高至70%~80%。然而,>60岁的患者预后仍然很差,5年OS小于20%。

图1 急性淋巴细胞白血病的一线治疗
注:*在ph+ ALL治疗的每个阶段给予酪氨酸激酶抑制剂。†鞘内化疗包括单独使用甲氨蝶呤或甲氨蝶呤联合阿糖胞苷和氢化可的松。‡在巩固后可选择异体造血干细胞移植。
诱导化疗
诱导化疗的目的是消除疾病负担,恢复正常造血,以达到完全缓解。ALL的标准诱导治疗方案包括糖皮质激素、长春新碱、L -天冬酰胺酶和蒽环类药物(图1)。ALL治疗的类固醇通常选择强的松,在儿童中逐渐被地塞米松取代。一项针对强的松与地塞米松剂量比(7或更低)的前瞻性随机试验证实,地塞米松在中枢神经系统白血病和无事件生存(event-free survival,EFS)方面优于强的松。然而,这一优势在大多数儿童中并没有转化为OS获益。类固醇与许多短期和长期不良反应有关,如感染、心理和行为障碍、骨质疏松症、骨坏死、肌病、内分泌和代谢功能障碍、心血管事件和白内障等。当患者服用高剂量类固醇时,发生不良反应的风险增加。相对于强的松,使用地塞米松的不良反应通常更为严重,且更常见。总的来说,考虑到高剂量地塞米松对OS无益且毒性增加,不推荐这种治疗方案用于伴有B-ALL的AYAs。BCR-ABL1易位的ALL患者预后不良,酪氨酸激酶抑制剂可改善其临床结局。
巩固治疗
ALL缓解后若不给予巩固治疗,绝大多数患者将于数周至数月内复发。巩固是ALL治疗的第二步,包括每2周进行几个短的连续化疗疗程,通常使用阿糖胞苷、高剂量甲氨蝶呤(500 mg/m)、长春新碱、天冬酰胺酶、巯基嘌呤和糖皮质激素,持续12周。高剂量甲氨蝶呤会增加复发风险,需要使用叶酸进行解救,但应谨慎使用。药物基因组学研究发现,体细胞获得性病变能显著增加或减少(取决于病变情况)白血病细胞中多聚谷氨酸甲氨蝶呤的累积。多聚谷氨酸甲氨蝶呤是甲氨蝶呤的活性代谢物,与抗白血病活性相关。
强化治疗
巩固之后是后期强化(再诱导治疗),包含在诱导治疗中使用的类似药物。
维持治疗
维持治疗包括每日服用巯基嘌呤和每周服用甲氨蝶呤,加或不加长春新碱,以及每1-3个月服用一次糖皮质激素。诱导后维持治疗2~3年,延长时间未见明显获益。巯基嘌呤是维持治疗的标准治疗方法。药物基因组学在巯基嘌呤不良反应监测中尤其重要。FDA已批准在巯基嘌呤的药品说明书中增加在用药前进行TPMT基因多态性检测的建议。TPMT酶活性低的个体在接受6-MP治疗时应减少用药剂量或考虑更换其他药物,以避免发生严重的造血系统毒性。
中枢神经系统预防和治疗
常规中枢神经系统复发的预防应与全身化疗同时进行。目前的治疗方案包含单独使用甲氨蝶呤、或甲氨蝶呤与阿糖胞苷和氢化可的松联合的鞘内强化化疗。
异基因造血干细胞移植
对于一般状况良好且有供体的高危患者而言,标准的巩固治疗仍是异体造血干细胞移植。随着支持性护理、感染的预防和治疗、化疗毒性反应的降低等方面技术水平的提高,使得移植术后的非复发死亡率显著降低。异体造血干细胞移植被推荐为ph+ ALL的一线巩固方案,也适用于ph- 的成人ALL患者,以及诱导或巩固治疗后持续MRD的患者。对于取得二次完全缓解(complete remission, CR)、一般状况良好的复发或难治性ALL患者(尤其是成人),通常推荐异基因造血干细胞移植,这类患者预后非常差。
ALL的新药
在过去的十年中,已开发出多种新的ALL靶向治疗方案(图2)。
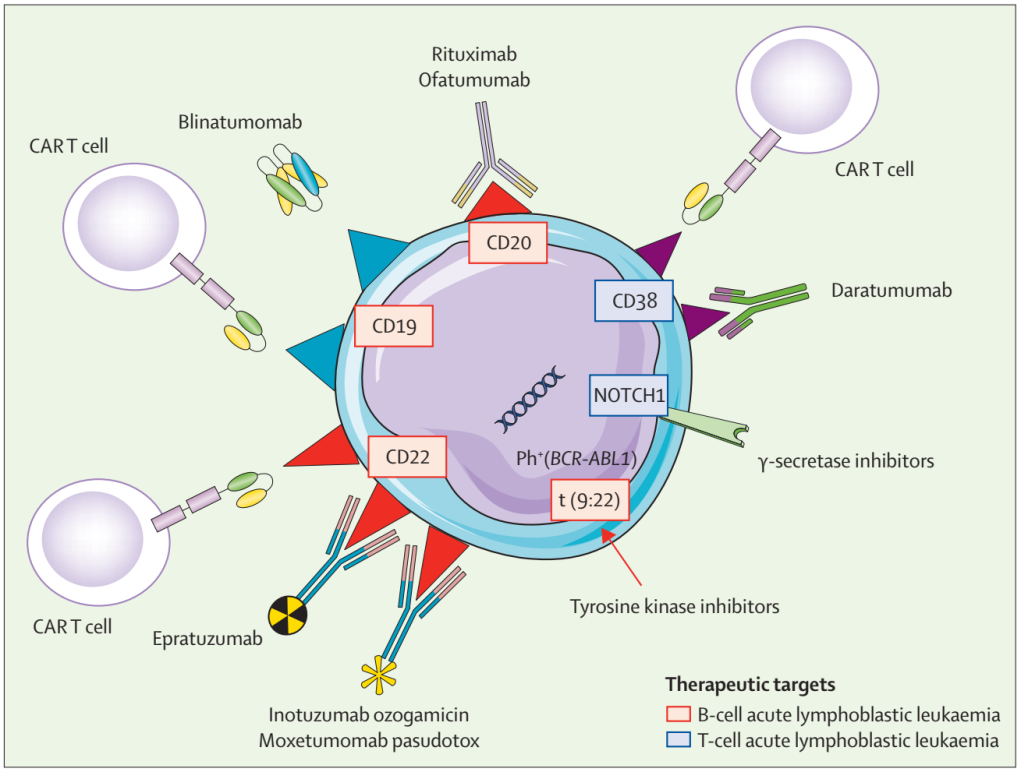
图2 急性淋巴细胞白血病新的靶向治疗
1)CD20
30-50%的B-ALL患者表达CD20。在成人ALL中,CD20与预后不良相关。在成人复发或难治性ALL患者中,抗CD20单克隆抗体利妥昔单抗(Rituximab)的疗效显著。抗CD20单克隆抗体奥法木单抗(Ofatumumab)也显示了类似结果。因此,抗CD20单克隆抗体有望纳入CD20阳性B-ALL患者的一线治疗。
2)CD22
90%的B-ALL患者表达CD22,其与抗体结合后快速内化,是免疫治疗的理想靶点。依托珠单抗(Inotuzumab ozogamicin)是一种抗CD22单克隆抗体,已被FDA和EMA批准用于复发或难治性ALL成人患者的治疗。依托珠单抗与较高的肝毒性发生率有关。其它的CD22抗体包含依帕珠单抗,moxetumomab pasudotox和combotox。
3)CD19
与CD22一样,约90%的B-ALL患者表达CD19,并在与抗体结合后迅速内化,是另一个合适的治疗靶点。博纳吐单抗(Blinatumomab)是一种抗T细胞和CD19的双特异性抗体,FDA和EMA已批准用于治疗费城染色体阴性、CD19阳性、复发/难治性,或第1/2次CR后伴有持续性MRD的ALL成人患者,还被批准用于费城染色体阴性和CD19阳性,两次治疗后复发/难治,或异体造血干细胞移植后复发的1岁或以上的儿童ALL患者。博纳吐单抗的不良反应包含发热、发冷、中性粒细胞减少、贫血、低γ球蛋白血症,细胞因子释放综合征和神经毒性。其它的CD19抗体有denintuzumab mafodotin。
4)CAR-T细胞治疗
靶向CD19的CAR-T细胞免疫疗法是一种有前景的B-ALL治疗方法。EMA和FDA已批准CAR-T细胞治疗在其它两种疗法或移植失败后复发或难治性急性B-ALL患者(≤25岁)。然而,CD19 CAR-T细胞治疗与严重的不良反应相关,包括细胞因子释放综合征和神经毒性,可能危及生命。
小结与展望
剂量密集化疗的发展是儿科肿瘤学的重大成功,很大一部分患者可以实现持续完全缓解。相比之下,AYAs和成年人的预后较差。儿科强化化疗方案的益处首先在AYAs中表现出来,然后是成人。然而,考虑到毒性和与治疗相关的死亡率,有必要准确识别出该方案的获益患者。针对60岁以上患者、复发或难治性ALL患者(所有年龄组)的治疗仍具有挑战,这类患者常规治疗后CR率较低,OS较短。未来可能将单克隆抗体和CAR-T细胞疗法纳入一线治疗以改善临床结局。此外,还应着眼于降低低危儿童患者的治疗强度,以减少不良反应。
NGS技术的发展使我们能更好地对患者进行风险分层,识别靶向治疗的信号通路,从而有效地提供针对性治疗。例如,针对ph+和ph-like ALL的酪氨酸激酶抑制剂联合化疗有助于增加其进入缓解期的机会。新策略的实施有望改善成人ALL患者的临床结局。
参考文献
Malard F, Mohty M. Acute lymphoblastic leukaemia. The Lancet, 2020, 395(10230): 1146-1162.