急性淋巴细胞白血病(Acute lymphoblastic leukaemia,ALL)是一种起源于淋巴细胞的B系或T系细胞在骨髓内异常增生的恶性肿瘤性疾病。男女发病比例约为1.2 : 1,多见于儿童,在1-4岁儿童中发病率最高。约60%的急性淋巴细胞白血病是在20岁之前诊断出来的。ALL的特征是存在与淋巴前体细胞分化和增殖相关的染色体异常和基因改变,这些异常是重要的预后因素。根据肿瘤细胞的免疫表型可将ALL分为急性B淋巴细胞白血病(B-cell precursor acute lymphoblastic leukaemia, B-ALL)和急性T淋巴细胞白血病(T-cell precursor acute lymphoblastic leukaemia, T-ALL)。在过去的十年里,随着分子生物学的进步,我们对急性淋巴细胞白血病的认识取得了重大进展,本文主要总结了ALL的遗传学特征。
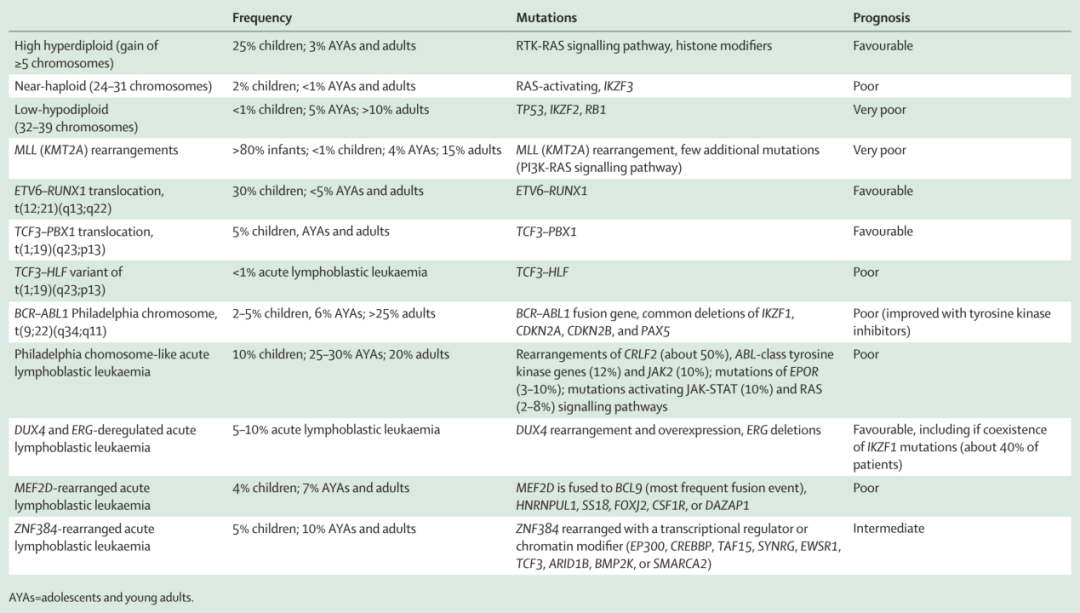
B细胞急性淋巴细胞白血病 (B-ALL) B细胞急性淋巴细胞白血病包含多种以染色体变异(包括非整倍性或染色体重组)为特征的亚型(表1)。染色体数目异常包含超二倍体(hyperdiploid)和亚二倍体(hypodiploid),染色体易位可导致融合基因的发生,主要包含TCF3-PBX1、BCR-ABL1、ETV6-RUNX1和MLL重排等。根据染色体异常确定ALL的疾病亚型是危险分层的重要步骤,其次,拷贝数改变和基因突变也是导致白血病发生的次级事件。 表1 B-ALL的主要亚型 1、超二倍体和亚二倍体 请输入 高超二倍体(High hyperdiploidy)是指至少增加5条染色体导致的染色体数目大于50,存在于25%的儿童ALL,小于3%的青少年和青年(adolescents and young adults, AYAs)以及成年ALL,且与预后良好相关。高超二倍体ALL患者存在组蛋白修饰基因CREBBP、WHSC1、SUV420H1、SETD2和EZH2突变,或RTK-RAS信号通路基因FLT3、NRAS、KRAS和PTPN11突变。中位年龄在9-10岁的儿童更易发生21号染色体内部扩增,然而其预后存在争议。 亚二倍体(hypodiploid)是指常染色体缺失导致数目少于44条,包含两个亚型,分别具有不同的转录图谱和遗传学改变。具有RAS激活和IKZF3突变的近单倍体ALL (24-31条染色体)在儿童(2%)、AYAs和成年人(<1%)中都很罕见。低亚二倍体ALL(32-39条染色体)存在TP53、IKZF2和RB1突变,预后较差,且发病率随年龄增长而增加,在儿童中极为罕见(<1%),AYAs中为5%,成年人中超过10%。 2.KMT2A重排与TCF3-PBX1融合基因 请输入 KMT2A(MLL)重排见于80%以上的0-1岁患儿,在儿童和AYAs中的发生率约5%,在成人中的发生率约为15%。MLL重排的婴儿ALL患者很少有额外的突变,表明仅MLL突变足以诱导白血病转化。MLL重排与预后不良相关。 TCF3-PBX1融合基因与预后良好相关。TCF3-PBX1见于约5%的儿童和成人。相比之下,TCF3-HLF见于不到1%的ALL中,与预后不良相关。 3. BCR-ABL Ph ALL 和 Ph-like ALL 请输入 BCR-ABL融合突变的发生率随着年龄的增长而增加(儿童2%,AYAs 6%,成年人25%以上),且与预后不良相关,此类患者对酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)治疗敏感。IKZF1突变是BCR-ABL1和Ph-like ALL的标志,与预后不良相关。 Ph-like ALL与Ph ALL具有相似的基因表达谱,但缺乏BCR-ABL融合基因。Ph-like ALL的基因组改变影响B淋巴细胞转录因子、细胞因子受体和酪氨酸激酶信号,这些分类包括CRLF2基因重排(IGH-CRLF2和P2RY8-CRLF2;50%),ABL类酪氨酸激酶基因重排(ABL1、ABL2、CSF1R、PDGFRA、PDGFRB;12%),JAK2重排(5-10%),EPOR突变(3-10%),JAK-STAT激活突变(JAK1、JAK2、TLT3、ILR7、SH2B3和TSLP;约10%)和RAS信号通路突变 (NRAS、KRAS和PTPN11;2-8%),以及其他不太常见的激酶异常(FLT3、NTRK3和FGFR1)。激酶亚型的频率随年龄而改变,如ABL类重排常见于儿童和青少年,CRLF2重排和RAS信号通路激活突变常见于青少年,EPOR突变多见于青少年和青年人,JAK2重排常见于成年人。儿童和成人Ph-like ALL都与不良预后有关,靶向ABL1或JAK2的酪氨酸激酶抑制剂可能提高应答率。 4. ETV6-RUNX1和ETV6-RUNX1-like ALL 请输入 ETV6-RUNX1与预后良好相关(表1)。ETV6-RUNX1见于约30%的儿童ALL,在AYAs和成人ALL中较少见(<5%)。 ETV6-RUNX1-like ALL具有与ETV6-RUNX1亚组相似的基因表达谱和免疫表型,但没有ETV6-RUNX1融合基因。分子特征是ETV6和IKZF1异常以及ARPP21缺失。这种亚型主要见于儿童,发生频率较低(约3%),其对预后的影响尚不明确。 5. DUX1重排、MEF2D重排、ZNF384重排、 IGH重排、PAX5重排等 请输入 DUX4重排ALL具有独特的免疫表型(CD2阳性)和基因表达谱(DUX4和ERG异常)。DUX4重排是白血病发生的早期启动事件,约占ALL的5%- 10%,在AYAs中的发生频率略高于儿童和成人。这类重排的患者预后良好(即使同时存在与预后不良相关的基因组改变时,预后仍然较好)。 MEF2D重排B-ALL是一种与老年患者发病(约4%的儿童vs 7%的AYAs和成年人)和异常免疫表型(CD10阴性和CD38阳性) 相关的遗传亚型。MEF2D最常见的融合基因是BCL9,但也可与HNRNPUL1、SS18、FOXJ2、CSF1R或DAZAP1发生融合。这种亚型与预后不良相关。 ZNF384重排B-ALL亚型见于年龄较大的人群(5%的儿童vs. 10%的AYAs和成人),重排基因通常是转录调节或染色质修饰基因(EP300、 CREBBP、 TAF15、 SYNRG、 EWSR1、 TCF3、 ARID1B、BMP2K或SMARCA2)。ZNF384重排B-ALL常被诊断为伴有CD13、CD33等髓系抗原异常表达的B-ALL,或B/髓系混合表型急性白血病。淋巴和髓系抗原的表达提示ZNF384重排可能发生在具有多系潜能的早期造血祖细胞中。一项小队列研究报道,ZNF384重排ALL的预后中等。 IGH与不同的基因重排(包括CRLF2、EPOR、CEBP基因家族成员和ID4基因)见于AYAs,预后较差。PAX5基因异常见于31%的B-ALL,PAX5易位见于2~3%的B-ALL患者,这类重排抑制PAX5的转录活性,从而加速前体B细胞白血病的发展。 6. IKZF1plus 请输入 IKZF1plus被归类为IKZF1缺失,当无ERG缺失时,它与CDKN2A、CDKN2B、PAX5或PAR1缺失共同发生。这一亚类见于约6%的儿童B-ALL,且与预后不良相关,特别是在诱导治疗后MRD阳性的患者中。 7.复发B-ALL 请输入 表观调控因子和染色质修饰因子的基因突变在复发ALL患者中较为常见,可能导致较差的治疗反应。CREBBP基因突变见于约20%的复发B-ALL,对糖皮质激素治疗的反应差。复发B-ALL的NT5C2基因突变导致对巯基嘌呤治疗耐药。复发B-ALL中,其它常见的突变基因包括WHSC1、TP53、USH2A、NRAS和IKZF1,以及DNA错配修复基因PMS2和MSH6的体细胞突变。 T细胞急性淋巴细胞白血病 (T-ALL) 几乎所有的T-ALL患者都伴有染色体异常,具有高度异质性。80%的T-ALL患者存在由NOTCH1激活突变或FBXW7缺失突变引起的NOTCH信号的组成性激活。此外,70%的T-ALL患者存在CDKN2A位点p16(INK4A)和p14(ARF)抑制基因的缺失。因此,NOTCH信号的组成性激活与CDKN2A位点的缺失协同促进肿瘤发生。 约50%的T-ALL中,染色体易位累及转录因子基因,使其表达受T细胞特异性增强子(T细胞受体α, β, δ)控制。过表达的原癌基因产物即转录因子包括TAL1、TAL2、LYL1、OLIG2、 LMO1、LMO2、TLX1(HOX11)、TLX3(HOX11L2)、NKX2-1、NKX2-2、NKX2-5、HOXA、MYC、 MYB和TAN1。在少数的情况下,这类易位会导致发挥肿瘤抑制作用的关键转录因子丢失,包括WT1、LEF1、ETV6、BCL11B、RUNX1、GATA3。 据报道,约25%的T-ALL患者存在AZH2和SUZ12基因缺失和丧失功能突变,约16%的儿童和38%的成人T-ALL患者存在PHF6基因突变或缺失。 T-ALL中还存在信号转导通路基因异常,包括PTEN突变和ABL1重排(ABL1-NUP214、ABL1-EML1、ABL1-ETV6)。ABL1融合蛋白对酪氨酸激酶抑制剂治疗敏感,TKI与化疗联合治疗可能提高该亚型患者的疗效。 DNMT3A突变通常见于骨髓恶性肿瘤中,也存在于T细胞谱系(包括约10%的T-ALL患者),且与不良预后相关。DNMT3A突变的发生率随年龄增加(中位年龄为44岁),在非白血病骨髓中检出DNMT3A突变的结果提示,一部分T细胞白血病可能起源于DNMT3A突变的克隆性造血。 总结 新一代测序技术的发展极大地改善了我们对疾病风险分层的认识,不仅使我们能识别新的急性淋巴细胞白血病亚群,还能对亚群预后有更准确的定义。此外,对于信号通路的识别有助于靶向药物的治疗指导,如Ph ALL和Ph-like ALL中的酪氨酸激酶抑制剂。这些进展有助于患者选择更好的治疗方式。 参考文献 Malard F, Mohty M. Acute lymphoblastic leukaemia. The Lancet, 2020, 395(10230): 1146-1162.