

急性髓系白血病(Acute myeloid leukemia, AML)是一种高度异质性的恶性肿瘤,其特征是反复出现的遗传学、表观遗传学和代谢异常。AML相关基础生物学知识的不断增长推进了合理的药物开发。目前,AML治疗领域的发展迅速,也为患者预后的改善带来了新的希望。图1展示了2017至2019年FDA批准的8种AML靶向药物,包括FLT3抑制剂Midostaurin和Gilteritinib,IDH1抑制剂Ivosidenib,IDH2抑制剂Enasidenib,BCL2抑制剂Venetoclax等。随着越来越多新的靶药出现,AML的治疗已逐步从传统的联合化疗、移植的治疗模式步入个体化精准治疗的新时代,因此,对新确诊AML和复发时进行全面的分子分型以选择最佳治疗方案变得越来越重要。本文重点回顾新的AML单药和联合生物制剂(FLT3抑制剂随后将单独论述),并就如何将其有效地应用于临床实践提出了建议。
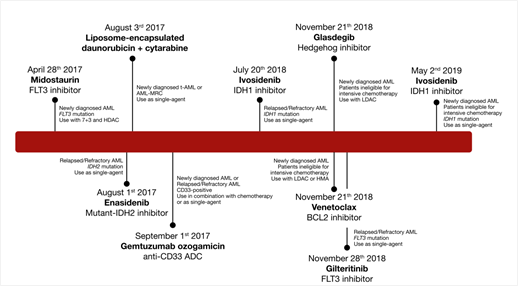
图1 FDA近期批准的AML靶向药物
(ADC, 抗体偶联药物; AML-MRC, 急性髓系白血病伴骨髓增生异常相关改变; HDAC, 大剂量阿糖胞苷; HMA, 低甲基化试剂; LDAC, 低剂量阿糖胞苷。)
01 CPX-351(Vyxeos)
2017年8月,FDA批准CPX-351(Vyxeos)用于治疗继发(治疗相关)和伴有MDS相关细胞遗传学异常(MRC)的急性髓系白血病。研究表明,在新诊断的、治疗相关的AML或伴有MDS相关遗传学异常的老年AML患者中,CPX-351疗效优于标准7 + 3方案。
CPX-351是阿糖胞苷和柔红霉素按照5:1比例组合的脂质体,脂质体载体能增加白血病细胞的摄取率。在最初的一项II期随机临床研究中,CPX-351与标准化疗方案(7+3)比较,研究纳入60 - 75岁的新诊断AML患者。在整个队列中,CPX-351组的CR/CRi率高于7+3组(66.7% vs 51.2%, P =0 .07),在细胞遗传学不良(77.3% vs 38.5%, P =0 .03)和继发性AML (57.6% vs 31.6%, P 5=0.06)患者中差异最为显著。继发AML亚组的中位OS也有所改善(12.1 vs 6.1个月,P =0 .01),而在整个队列中未见显著差异。
该研究引出一项验证性的3期随机临床试验,CPX-351 与7+3分别用于新诊断的老年继发性AML患者,包括治疗相关的AML(t-AML)和伴有MDS相关遗传学异常的AML(AML-MRC)。在本试验中,与标准化疗方案7+3相比, CPX-351组患者的CR/CRi率更高 (33.3% vs47.7%, P =0. 016),OS更长(5.95 vs9.56个月,P =0. 003),中位随访时间为20.7个月。OS的改善部分是由于CPX-351治疗组接受HSCT的患者比例更高(34% vs 25%),这些患者的预后特别好(12月OS>60%)。虽然MRD的评估不是集中进行的,但CPX-351组术后HSCT结果的改善可能表明,脂质体配方可以实现更深层的缓解。在亚组分析中,与治疗相关的AML、从慢性髓细胞性白血病演变而来的继发性AML或未接受HMA治疗的继发性AML患者获益最大。
02 Ivosidenib and enasidenib
2017年8月,FDA批准Enasidenib用于治疗IDH2突变的成人复发/难治的AML患者。2018年7月,FDA批准Ivosidenib用于治疗IDH1突变的复发/难治AML患者,2019年5月,Ivosidenib被批准用于年龄≥75岁或不适合强化化疗的新诊断的成人AML患者。
异柠檬酸脱氢酶(IDH)酶IDH1和IDH2的重现性突变在15%-25%的AML患者中存在。IDH1和IDH2是催化异柠檬酸转化为α酮戊二酸(α-KG)的关键酶,而突变的IDH1/2酶可将α-KG转化为2-羟戊二酸(2-HG),2-HG可竞争性抑制α-KG介导的反应,抑制组蛋白和DNA去甲基化,引起细胞分化阻滞,参与的白血病发生。IDH1/2的突变与中风险核型、NPM1和DNMT3A突变以及年龄有关。IDH1/2突变对预后的影响取决于突变的位置和同时发生的其他遗传学异常。例如, NPM1和IDH1/2共同突变的患者预后良好。
Enasidenib是一种口服IDH2突变选择性抑制剂。对239例IDH2突变的髓系恶性肿瘤患者进行评估,1/2期研究包括176例(73%) 复发或难治性AML患者。剂量为100 mg时,总体有效率(包括CR、CRi、MLFS)为38.8%,CR率为19.6%。中位反应时间为1.9个月(0.5-9.4个月),中位DOR为5.6个月(DOR, CR患者为8.8个月)。大约1/2的患者病情稳定,平均治疗时间为4个月,部分患者的好转与血液系统的改善和输血负担的减少有关。中位随访时间为7.8个月,中位OS为8.8个月(7.7-9.6个月),该研究表明Enasidenib优于以往任何的抢救性化疗。
一项I期研究评估了口服IDH1抑制剂Ivosidenib的安全性和有效性,研究共纳入258例IDH1突变的复发/难治性AML患者,接受Ivosidenib 500 mg/d治疗并至少随访6个月。Ivosidenib的总缓解率(CR、CRi和MLFS)为41.6%,CR率为21.6%。响应的平均时间是1.9 (0.8 - 4.7),DOR中值为6.5个月(4.6 - 9.3),DOR是9.3个月的病人实现CR。平均随访14.8个月,OS中值为8.8个月(6.7 - 10.2)。研究表明,Ivosidenib治疗IDH1突变的复发或难治性AML有良好的疗效和安全性。此外,在不适合强化化疗的老年患者中,Ivosidenib单药治疗的CR/CRh率为42%,CR率为30%,中位OS为12.6个月。
03 Glasdegib (Daurismo)
2018年11月,FDA批准Glasdegib与低剂量阿糖胞苷(LDAC)联合治疗年龄≥75岁或不适合强化化疗的新诊断的成人AML患者。研究显示,与LDAC单药治疗相比,Glasdegib与LDAC联合使用可降低54%的死亡风险。
Gladegib是一种口服hedgehog通路抑制剂。一项II期临床试验纳入115例新诊断的AML患者,以2:1的比例随机接受Gladegib联合LDAC(n=77)或LDAC单药(n=38)治疗。Glasdegib/LDAC与LDAC组的OS中位数分别为8.3个与和4.3个月,Glasdegib联合LDAC组的完全缓解率为18.2%,而LDAC组的完全缓解率为2.6%。
04 Gemtuzumab ozogamicin (GO)
2017年9月1日,FDA批准吉妥珠单抗(Gemtuzumab ozogamicin, Mylotarg)用于治疗表达CD33抗原的新诊断成人AML患者。同时也批准用于治疗2岁及以上CD33阳性难治或复发AML患者。研究显示,吉妥珠单抗(GO)可提高细胞遗传学良好或中等风险CD33阳性患者的无事件生存。
吉妥珠单抗(GO)是一种靶向CD33的抗体-药物偶联物,与卡其霉素calicheamicin偶联。吉妥珠单抗与抗原CD33特异性结合后可被髓细胞“内化”,在髓细胞的溶酶体内通过水解作用释放刺孢霉素。刺孢霉素导致DNA双链断裂,诱导细胞死亡。该药曾在2000年获FDA批准用于治疗表达CD33抗原的复发老年 AML,随后由于临床疗效和安全性等问题于2010年6月撤市。该药的重新获批基于ALFA-0701临床试验的结果,该研究纳入278名CD33阳性的新诊断AML成人患者(50-70岁)。随机分配接受GO (3 mg/m2 , d1,4,和7)与柔红霉素(60 mg/m2)和阿糖胞苷联合治疗,或只接受柔红霉素和阿糖胞苷治疗。结果显示,接受GO与化疗联合治疗患者的总生存 (OS) 和无事件生存期 (EFS) 长于那些只接受化疗的患者,中位OS 分别为34月和19.月(P=.046),中位EFS分别为19.6个月和11.9个月(P=.00018)。
05 Venetoclax
2018年11月,FDA批准Venetoclax与阿扎胞苷或地西他滨或HMA联合用于治疗不适合强化化疗的新诊断AML患者或≥75岁的老年AML患者。研究显示,Venetoclax联合低剂量阿糖胞苷(low-dose cytarabine,LDAC)或低甲基化药物(hypomethylating agents,HMAs)对不适合强化化疗的新诊断老年AML患者具有良好的安全性和疗效。
Venetoclax是BCL2的选择性抑制剂,BCL2是一种抗凋亡蛋白,AML在内的多种血液恶性肿瘤的共同机制是BCL-2蛋白过度表达,导致抗凋亡通路异常,venetoclax可选择性结合并抑制BCL-2蛋白的表达。最新临床数据显示,在初发老年白血病中,Venetoclax联合低剂量阿糖胞苷的CR/CRI率为62%,而Venetoclax联合HMA的CR/CRI率高达73%。在Venetoclax(400mg或800mg)联合HMA临床试验中,共入组145例老年初发白血病患者,中位年龄为74岁,其中49%患者具有不良预后的细胞遗传学。所有患者(所有剂量)CR+CRI率达67%,在Venetoclax 400mg+HMA队列中CR+CRI率为73%,其中NPM1突变组CR+CRI率最高91%,其次分别为IDH1/IDH2突变组72%,FLT3突变组71%,TP53突变组最低47%。总体CR/CRI率平均反应持续时间为11.3个月,中位生存时间为17.5个月,第1次反应的中位时间为1.2个月,最佳反应时间为2.1个月。多参数流式细胞术评估显示,29%的患者MRD阴性。
小结与展望
数十年来,AML的治疗一直是基于传统的阿糖胞苷联合柔红霉素的7+3治疗方案,随着人们对疾病分子机制的深入了解,新型分子靶向药物为AML患者的治疗带来了希望。在过去的2年里有8种新药获批,可以预期的是,AML的治疗正在跨入个体化“精准医疗”的新时代。图2展示了分子分型如何指导新诊断AML的治疗方案,反复进行的分子分型不仅可以辅助疾病的诊断和预后评估,还能为新确诊和复发患者提供直接的治疗指导。
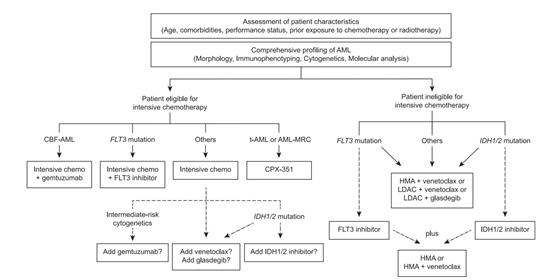
图2 新诊断AML的单药和联合治疗流程
(CBF-AML, 核结合因子急性髓系白血病; chemo, 化疗; HMA, 低甲基化制剂; t-AML, 与治疗相关的急性髓系白血病。虚线表示疗效不明确和/或值得进一步研究的治疗方案,该流程不包括急性早幼粒细胞白血病的治疗。)
参考文献
Richard-Carpentier Guillaume, et al. Single-agent and combination biologics in acute myeloid leukemia. Hematology Am Soc Hematol Educ Program, 2019: 548-556.