

摘要
DNA损伤修复(DDR)在实体瘤(包括卵巢癌)的发生中起重要作用。在DDR效应通路中,多种实体瘤(如乳腺癌、结直肠癌和卵巢癌)遗传学水平的实质性变化就是DNA修复基因的基因组改变,尤其是在携带已知DNA修复基因胚系突变的高外显率家族性肿瘤中,例如乳腺癌相关的BRCA1/2突变,结直肠癌和卵巢癌(OvC)相关的错配修复基因突变(包括MLH1、MSH2、MSH6、PMS2和POLE)或聚合酶缺陷,以及OvC相关RAD51C、RAD51D基因的有害突变和BRCA1突变。卵巢癌相关的其他分子标志物还包括TP53、KRAS、BRAF、RAD51C/D或PTEN等。本文阐述了DNA修复机制对卵巢癌发生风险、预后和治疗结局的影响。
卵巢癌的主要分子特征及其与DNA修复系统的关系
90%的OvC为上皮性卵巢癌(EOCs),主要分为Ⅰ型和Ⅱ型两个亚型,Ⅰ型由子宫内膜样、粘液样、透明细胞和低级别浆液性卵巢癌组成,Ⅱ型包括高级别浆液性卵巢癌(HGSOCs),属于组织学优势亚型。DNA修复系统的蛋白由150多个基因编码并具有典型特征,OvC涉及六个途径:其中同源重组修复(HR)缺陷、非同源末端连接(NHEJ)、错配修复(MMR)、碱基切除修复(BER)和核苷酸切除修复(NER)主要与OvC起源、发病机制和对化疗的反应相关,而损伤直接修复与OvC的关系研究较少。相关研究表明,所有DNA修复通路都参与了卵巢癌的发生(见图1)。位于G1/S检查点的DNA损伤修复主要通过NHEJ、BER、NER途径;S期检查点的DNA损伤修复通过MMR、HR、NHEJ、BER等途径;G2/M检查点的DNA损伤修复途径主要为NHEJ、BER和HR。
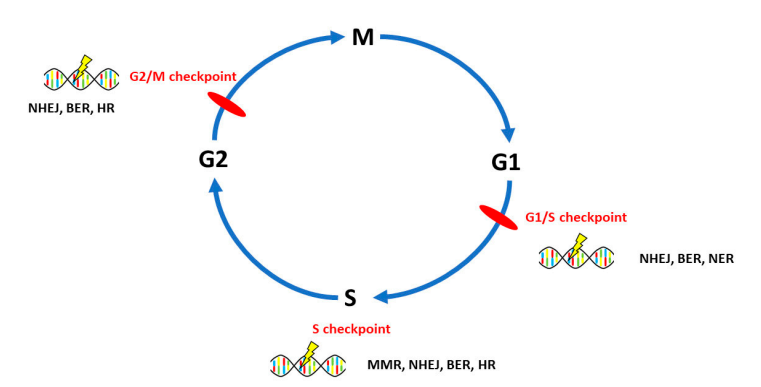
图1 DNA修复途径及其在细胞生物学中的意义
从分子分型来看,临床上最常见的侵袭性II型卵巢癌(主要是HGSOC)的典型特征是TP53的体细胞突变、染色体不稳定和经常出现的同源重组(HR)缺陷。HGSOC中有96%的病例发生TP53突变,其中约50%的肿瘤由于胚系和体细胞BRCA突变、BRCA表观失活和DNA修复基因异常而表现出HR缺陷。约10-20%的上皮性卵巢癌(EOC)的危险因素是BRCA1/2胚系突变。I型EOC包括低级别浆液性和粘液性卵巢癌,通常发生KRAS和BRAF突变,还有ARID1A、CTNNB1、PIK3CA、PTEN基因突变。与EOC发病风险相关的基因还包括BRIP1、RAD50、RAD51C、RAD51D、BARD1、CHEK2、MRE11A、PALB2、ATM。
DNA修复通路参与卵巢癌的发生、发展和预后
01
同源重组修复(Homologous Recombination Repair,HRR)
HR是一种重要的高保真DNA修复途径,可对DNA缺口(gaps)、DNA双链断裂(DSBs)和DNA链间交联等复杂DNA损伤进行修复,具有模板依赖性(见图2)。大约50%的HGSOC中存在HR通路缺陷,OvC患者的HR缺陷主要是由高外显率易感基因BRCA1/2的胚系和体细胞突变驱动的。BRCA1和BRCA2蛋白在DBSs修复中发挥重要作用,BRCA1和BRCA2基因突变与遗传性乳腺癌和OvC的高风险相关。研究表明,与非携带者相比,BRCA1/2突变携带者的生存率显著提高,可能部分与他们对铂类化疗的敏感性增强有关。非携带者的五年生存率为36%,BRCA1和BRCA2突变携带者的5年生存率分别为44%和52%。HR缺乏的OvC患者接受铂类化疗后表现出显著较高的反应率和延长的无进展生存期(PFS)。
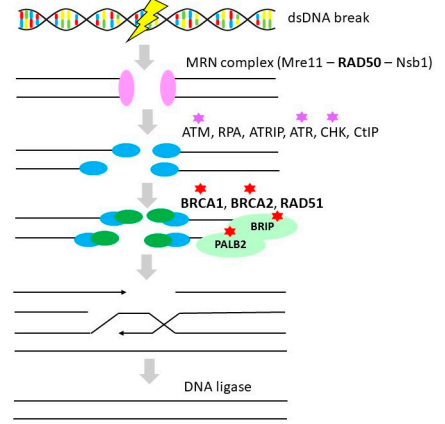
图2 同源重组(Homologous recombination)
注:粗体代表OvC中的基因改变,红星代表OvC治疗的靶点(PARP抑制剂),紫星代表检查点抑制剂。
此外,RAD51C和RAD51D突变与EOC的风险相关,可用于常规临床基因检测。RAD51同源基因被认为是中度外显的OvC易感基因,约占OvC病例的1%。PALB2和BRIP1是HR的另外两个重要成员,PALB2与BRCA2、BRCA1和DDR家族的几个成员相互作用,BRIP1具有ATP酶和解旋酶活性,可增加OvC的易感性。
02
非同源末端连接(Non-Homologous End-Joining,NHEJ)
NHEJ是DNA DSBs最有效的修复途径。与HR不同,DNA损伤直接连接而无需同源模板。由于不需要姊妹染色单体(在S期和G2期可用),NHEJ可贯穿于整个细胞周期(见图3)。NHEJ涉及的胚系突变与严重的免疫缺陷、发育异常、基因组不稳定以及不同的癌症类型有关,例如白血病、膀胱癌。XRCC4和LIG4是与OvC相关的NHEJ通路的两个成员,XRCC4的高表达与OvC患者的不良预后相关;LIG4是NHEJ中的一种必需蛋白,与XRCC4形成复合物,目前没有充足的证据证明LIG4与OvC的风险和预后相关。
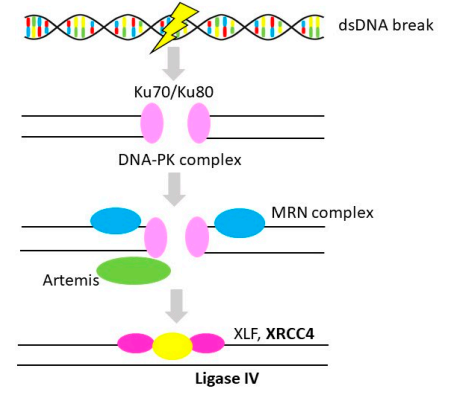
图3 非同源末端连接(Non-Homologous End-Joining)
注:粗体代表OvC中的基因改变。
03
错配修复(Mismatch Repair,MMR)
除BRCA1和BRCA2突变外,MMR缺陷是遗传性OvC的最常见致病因素。MMR系统可以纠正DNA复制或重组过程中产生的DNA碱基错配或插入/缺失,如图4所示。MMR基因(MLH1、MSH2、MSH6和PMS2)的胚系突变或MSH2表达缺失可能导致Lynch综合征(也称为遗传性非息肉病结直肠癌),该综合征患者发生OvC的累积风险为6-12%。由于DNA MMR失活而出现的特征分子标记称为微卫星不稳定性(MSI)。OvC患者中MSI的发生率约为2-20%,主要涉及子宫内膜样(19.2%)、粘液样(16.9%)、透明细胞(11.2%)和浆液性(7.9%)亚型。
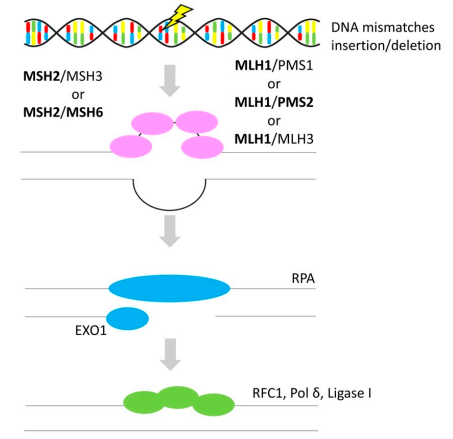
图4 错配修复(Mismatch Repair)
注:粗体代表OvC中的基因改变。
04
碱基切除修复(Base Excision Repair,BER)
BER是DNA修复机制的重要组成部分,负责修复由内源性(代谢产物)和外源性(辐射、化学物质、药物)损伤引起的碱基损伤(烷基化、氧化、脱氨、脱嘌呤或单链断裂(SSBs))。BER由DNA糖基化酶、APE1、POLB、FEN1和LIG1(或LIG3)几个部分组成,还有PARP1或XRCC1(见图5)。
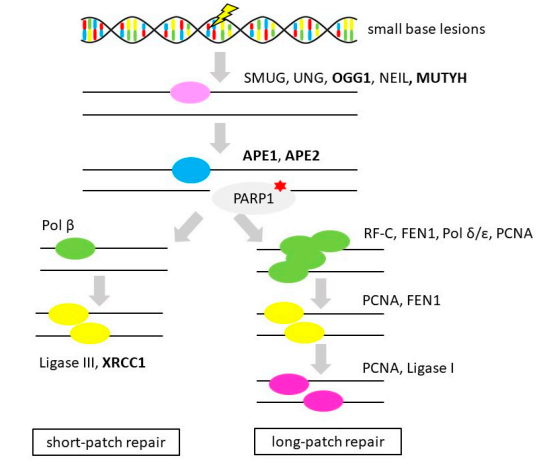
图5 碱基切除修复(Base Excision Repair)
注:粗体代表OvC中的基因改变,红星代表OvC治疗中考虑治疗干预措施(PARP抑制剂)。
05
核苷酸切除修复(Nucleotide Excision Repair,NER)
NER可识别出大的DNA双链螺旋扭曲和DNA化学改变,主要包括紫外光产物、多环芳香烃、芳香族胺、铂化产物等(见图6)。NER途径中几种蛋白质的缺乏与三种罕见的常染色体隐性遗传综合征有关,Cockayne综合征,着色性干皮病和光敏形式的硫营养不良。一项研究对89例OvC患者和356例对照人群中NER基因(包括XPA、XPC、XPD/ERCC2、XPF/ERCC4、XPG和ERCC1)的17个SNP进行分析,结果表明ERCC1、XPC和XPD/ERCC2可能与OvC的易感性有关。
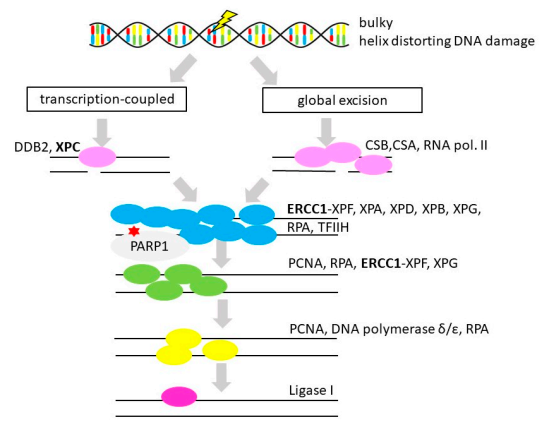
图6 核苷酸切除修复(Nucleotide Excision Repair)
注:粗体代表OvC中的基因改变,红星代表OvC治疗中考虑治疗干预措施(PARP抑制剂)。
06
直接修复(Direct Repair)
与其他DNA修复机制不同,直接修复是一种相对简单的方法,可去除一些DNA和RNA修饰。碱基损伤在单一酶反应中被消除,不用切断DNA或切除碱基,可实现无差错修复(见图7)。最常见的修饰包括由表观遗传机制引起的DNA烷基化损伤或RNA甲基化。
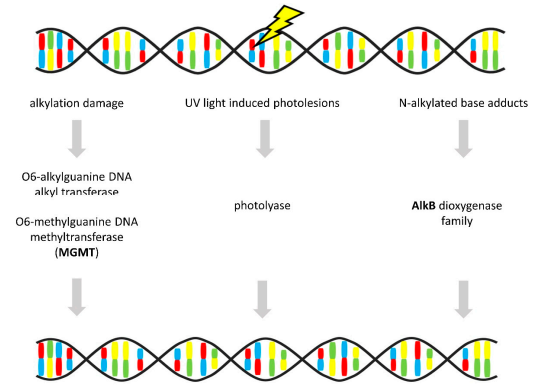
图7 直接修复(Direct Repair)
注:粗体代表OvC中的基因改变。
卵巢癌治疗——DNA修复系统的靶点
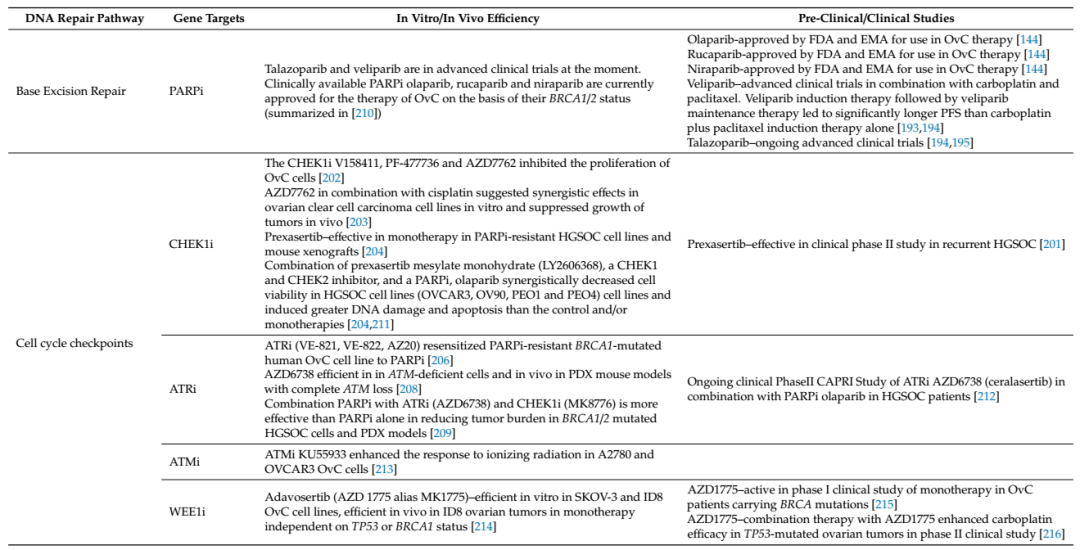
OvC的一线治疗以手术为主,其次是铂衍生物和紫杉类药物(通常是卡铂+紫杉醇)联合治疗。然而, 70-85%的患者会在初期缓解后复发,复发性OvC的中位生存期为12-24个月。目前,新的治疗方法直接针对分子靶点和信号通路,例如抗血管生成剂(如贝伐单抗或帕唑帕尼),生长因子信号抑制剂,叶酸受体抑制剂,AKT信号抑制剂,免疫治疗方法和PARP抑制剂(PARPi)。DNA修复靶向药已成为OvC的主流治疗选择,其目的在于检测DNA损伤,协调DNA修复,启动信号通路促进细胞周期检查点激活,触发细胞凋亡(见表1)。
表1基于DNA修复通路的卵巢癌靶向药研究进展
总结
虽然新的治疗策略不断涌现,OvC的长期疗效仍不能令人满意(五年生存率30%~50%不等)。研究表明,DNA修复机制与OvC的发生风险、疾病特征以及疗效预测有关。DDR与DNA修复系统的功能状态决定肿瘤的发生,并影响化疗疗效和预后。DNA修复通路基因的高通量遗传图谱使我们能够鉴定和筛选与OvC预后和疗效相关的关键基因(见图8和表2)。
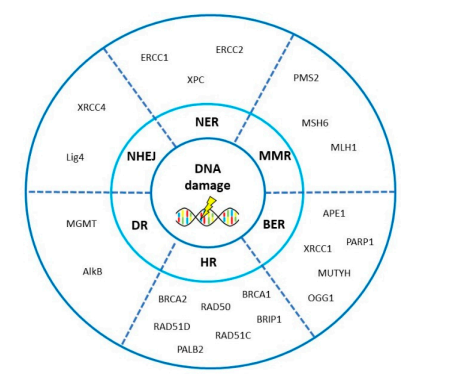
图8 卵巢癌(OvC)相关DNA修复途径的关键基因
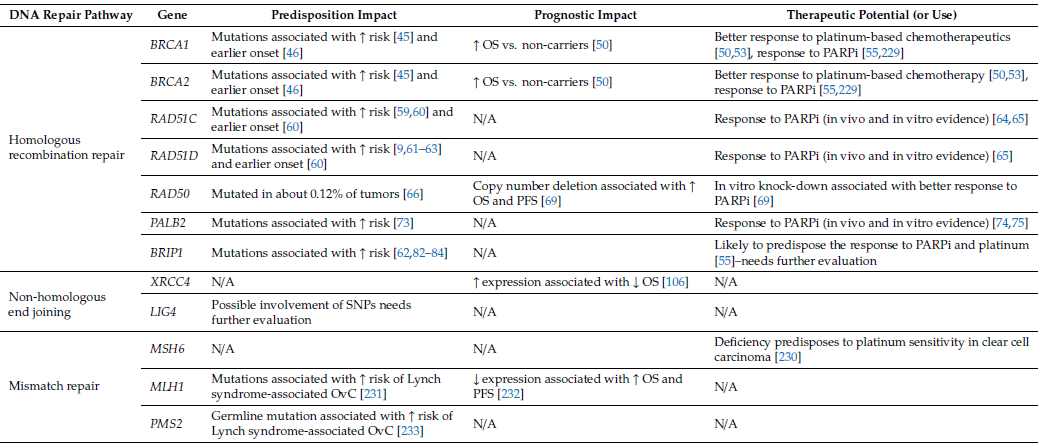
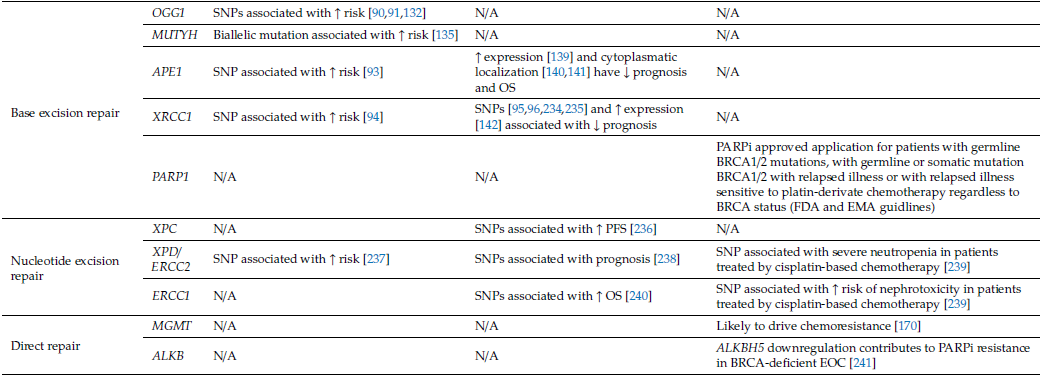
表2 DNA修复系统关键基因对卵巢癌遗传易感性、预后和靶向治疗的影响
参考文献:
Tomasova K, Cumova A, et al. DNA Repair and Ovarian Carcinogenesis: Impact on Risk, Prognosis and Therapy Outcome. Cancers (Basel). 2020 Jun 28;12(7):E1713.