


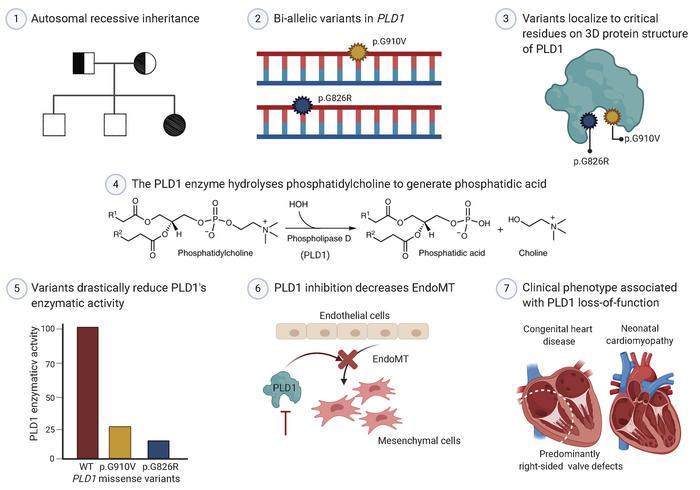
PLD1双等位基因功能缺失变异导致先天性
右侧心脏瓣膜缺损和新生儿心肌病
近期,Lahrouchi等对2718名先天性心脏病患者进行全外显子组测序(WES),并在GeneMatcher中搜索,确定了来自21个不相关家系的30名携带PLD1双等位基因变异的患者(主要表现为先天性心脏瓣膜缺损)。并且,将常染色体隐性遗传的PLD1基因变异与孤立性新生儿心肌病联系起来。此外,还证实了p.I668F是德系犹太人的奠基者变异(等位基因频率约2%),描述了PLD1相关先天性心脏缺陷的表型谱。PLD1的错义变异在对催化活性至关重要的蛋白区域过表达。同时,PLD1抑制降低了内皮间充质转化,这是瓣膜形成的关键早期步骤。
背景介绍
先天性心脏病是最常见的出生缺陷,占所有先天性异常的三分之一,在世界范围内每1000名活产婴儿中有7人患有先天性心脏病。大多数缺陷包含瓣膜形成异常,右侧先天性心脏病包括肺动脉瓣和三尖瓣、右心室和右心室流出道的异常。最近,在2个小家庭中发现PLD1与严重的右侧先天性心脏瓣膜缺损相关。PLD1基因编码磷脂酶D1,该酶是一种信号转导酶,可水解膜脂质磷脂酰胆碱产生脂质第二信使磷脂酸。
研究对象
研究纳入了来自荷兰国家先天性心脏缺陷登记和DNA库(CONCOR)的75名不相关的患有严重右侧先天性心脏瓣膜病(即三尖瓣闭锁或狭窄、Ebstein’s异常或肺动脉闭锁)患者,以及来自儿童心脏基因组学联合会(PCGC)并接受过WES检测的2643名先天性心脏病患者(包含患者和父母双方),共2718例。
研究方法
cDNA 分析;质粒构建、细胞系和转染;体外细胞PLD活性;蛋白质印迹分析;体外胶原蛋白凝胶实验;PCA确定PCGC先天性心脏病病例的谱系;单倍型分析和变异年代测定等。
研究结果
·在多个家系中,PLD1变异可导致先天性瓣膜缺陷或新生儿心肌病
对2718名患者进行分析,确定了来自21个不同祖先的不相关家系的30名携带纯合或复合杂合PLD1变异的患者。这30名患者在胎儿期或新生儿期均诊断为严重先天性心脏病或心肌病(见图1)。所有家系中都表现为常染色体隐性遗传模式,且PLD1变异均来自未受影响的父母。其中,来自19个家系的28名患者表现为先天性心脏瓣膜畸形,主要影响右侧心脏。值得注意的是,有2名患者表现为严重孤立性新生儿心肌病(即无结构性先天性心脏缺陷)(见图1A,Families T 和 U),这是该综合征的新发现。对这2名患者进行了约300个心肌病相关基因变异的筛查,结果均为阴性。总体而言,婴儿期后存活的患者均未出现畸形、智力残疾或显著的发育迟缓,这表明在明显的表型背景下,PLD1功能缺失主要与人类孤立性心脏病有关。
同时,3个德系犹太人家系中都携带PLD1 p.I668F纯合变异(见图1A,Families G、 H 和 I)。通过PCA分析,证实了p.I668F是德系犹太人的奠基者变异。有趣的是,p.I668F在gnomAD德系犹太人亚群中的MAF约为2%,而在其他人群中很少见(0.004%-0.14%)。
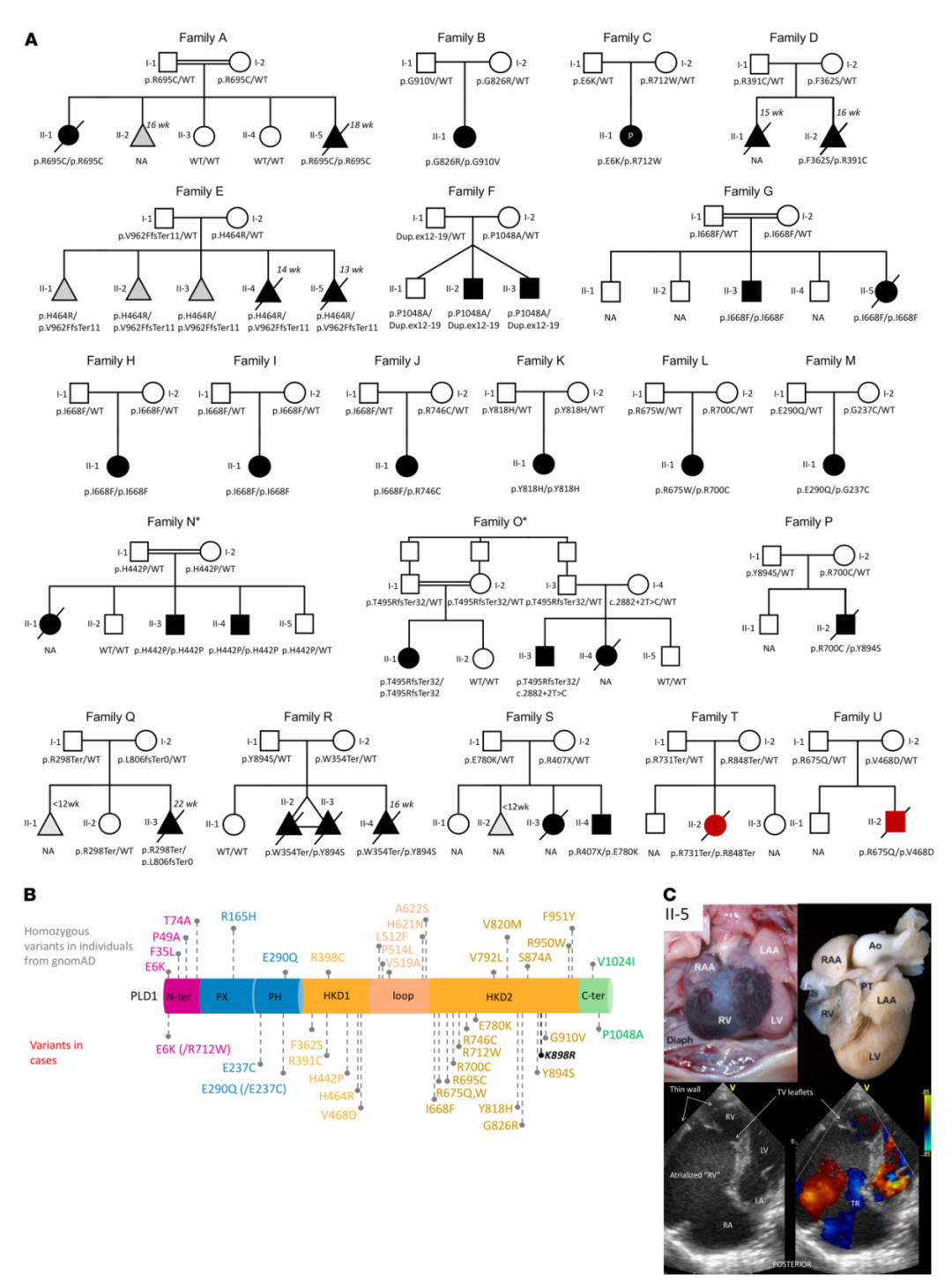
图1. PLD1常染色体隐性变异可引起一系列
先天性心脏瓣膜病和新生儿心肌病
·PLD1的错义变异导致酶活性降低
上述21个错义变异主要聚集在PLD1高度保守的HxKxxxxD(HKD)域和C末端区域,这些区域对酶活性至关重要(见图1B)。酶活性试验显示,在检测的19个变异中有17个变异的PLD1酶活性明显下降,与野生型PLD1等位基因个体相比,携带双等位基因PLD1变异的个体的PLD1活性一般低于25%(见图2)。由于完整的C末端是酶活性所必需的,因此预测所有导致PLD1蛋白过早终止的变异都将完全消除PLD1酶活性,例如患有孤立性心肌病的Families T中的p.R731Ter /p.R848Ter。值得注意的是,另一位孤立性心肌病(Families U)的患者携带复合杂合变异(p.V468D / p.R675Q),酶催化活性大大降低(与WT相比降低了2.7%)。因此,存在PLD1变异的孤立性心肌病患者的残留PLD1酶活性与心脏结构畸形患者相似。
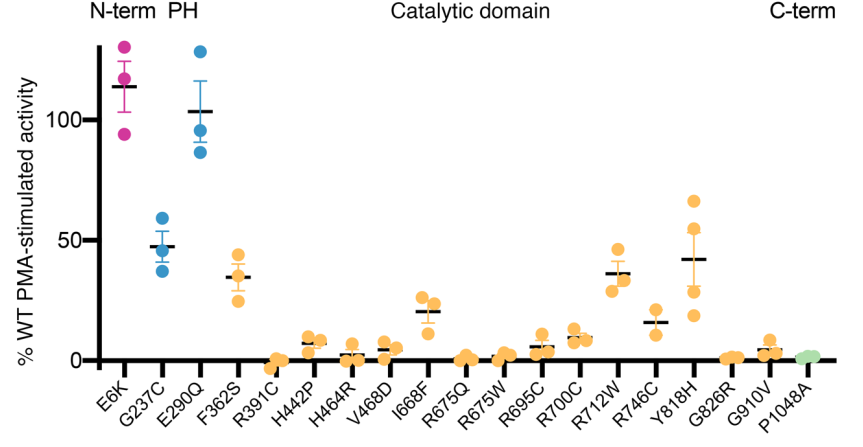
图2. 致病性PLD1基因变异的酶活性
·在房室垫外植体中,需要PLD1来实现心内膜细胞内皮间充质转化
PLD1功能缺失患者的主要畸形是结构性房室(AV)瓣膜缺损。在胚胎心脏中,覆盖在心室前垫上的心内膜细胞亚群经历了瓣膜形成的关键早期步骤—内皮间充质转化(EndoMT)。这些间充质细胞形成垫子,导致细胞外基质的重塑,并促进瓣膜和心脏间隔的发育。迄今为止,已经使用体外胶原蛋白凝胶测定系统鉴定了许多重要的EndoMT基因,并通过该方法证实了PLD1在体外参与了内皮间充质转化。异常的EndoMT至少是PLD1双等位基因功能缺失变异心脏结构畸形的部分原因。
结论
该研究建立了一个来自21个不相关家系的30名携带PLD1常染色体隐性变异的患者组成的队列,扩展了与PLD1相关的先天性心脏缺陷的表型谱;首次提出在没有先天性心脏缺陷的情况下,PLD1常染色体隐性变异也可引起新生儿心肌病;同时,发现p.I668F是德系犹太人的奠基者变异;还证实了部分PLD1的错义变异导致酶活性降低,以及PLD1参与了心内膜细胞内皮间充质转化。这些数据提供了对与PLD1遗传缺陷相关的疾病机制和表型表达的进一步理解。
参考文献:
Najim Lahrouchi, et al. Biallelic loss-of-function variants in PLD1 cause congenital right-sided cardiac valve defects and neonatal cardiomyopathy. J Clin Invest. 2021 Mar 1;131(5):e142148.
关于心肌病及相关检测的更多介绍,详见:
《Nature子刊最新研究——常见的遗传变异和可改变的危险因素是肥厚型心肌病易感性和表达性的基础》
《CSRP3 p.(Cys150Tyr)变异与杂合个体的迟发性肥厚型心肌病相关》